I detta kalla land önskar man ibland att det vore lite varmare. Men vad är värme egentligen?
Inledning
I detta spännande kapitel ska vi titta på en specifik typ av energi – nämligen energiformen värmeenergi. Värme används i många sammanhang, som du förstås vet, och det är absolut väldigt intressant att förstå vad värmeenergi är och hur den uppkommer. Detta ska vi försöka bena ut i det här kapitlet av Fysik 1! Vi börjar som vanligt lite grundläggande och för att avsluta med lite mer fördjupad kunskap! Tips: Följ länken för en bra beskrivning av termodynamikens lagar som är viktiga för kapitlet.
Temperaturskalor
Genom åren har ett antal temperaturskalor uppfunnits men det är främst två som har överlevt idag, nämligen Celsius och Kelvin (Fahrenheit är en annan skala som bland annat används i USA men den tar vi inte upp här).
Celsiusskalan
Denna skala bygger på vattnets fryspunkt och kokpunkt. Enligt Celsiusskalan är 0 grader den temperatur då vattnet fryser, och 100 grader är den temperatur då vattnet kokar. Lite kuriosa är att Celsius egentligen ville ha det tvärtom, men det har ändrats i efterhand för att bli enklare.
Kelvinskalan
Kelvinskalan används mycket oftare i vetenskapen på grund av att den utgår från den absoluta nollpunkten som vi kommer prata mer om senare. Kort och gott är den absoluta nollpunkten den lägsta temperatur ett ämne kan ha, och den ligger då i Kelvin på 0 kelvin, och i Celsius på ungefär -273,15 grader Celsius.
Det är Kelvin som är SI-enheten, alltså den enhet ni ska räkna med!
Temperatur
Temperaturen beror av hur mycket molekylerna i ett ämne rör sig. Ju mer de rör sig, desto högre är temperaturen, desto högre värme. Ämnen i fast form har sina molekyler ganska starkt bundna till varandra och de kan därför inte röra sig så mycket, till skillnad från gasformen där molekylerna är skilda från varandra och kan röra sig väldigt mycket. Men nu är vi snart förlorade i kemins värld, så vi nöjer oss med att konstatera att molekylrörelser ger temperatur.
Om molekylerna inte alls rör sig i ett ämne har ämnet nått den absoluta nollpunkten, 0 kelvin. Forskarna har dock aldrig lyckats kyla ner något ämne till den absoluta nollpunkten, men man har kommit väldigt nära(några tusendels grader ifrån!).
Observera att det alltså kan bli precis hur varmt som helst i universum, bara förutsättningarna för ökad molekylrörelse finns.
Värme
I fysiken definierar man(förenklat) värme som: ”energi som flödar från ett varmare ställe till ett kallare”. Detta är en av grundstommarna i termodynamik/värmelära och det är exempelvis därför det blir kallare i ett stekhett rum på sommaren när du öppnar fönstret. Om temperaturen utanför fönstret är lägre kommer energi att transporteras från rummet till utsidan i formen värme.
Värme kan transporteras på olika vis:
- Strålning, vilket exempelvis sker från solen.
- Ledning, via direkt kontakt, som från ett element till luften.
- Strömning, som exempelvis sker när en kastrull värms upp.
Inre energi
Nu har vi sett att temperaturen beror av hur mycket molekylerna rör sig och att värme är energi som transporteras från ett varmare till ett kallare ställe. Nu ska vi gå till kärnan av värmeläran och titta på vad värmeenergi (även kallat inre energi) egentligen är.
Atomerna i en molekyl är som vi tidigare nämnt inte helt låsta om temperaturen är över den absoluta nollpunkten. Atomerna rör alltså på sig. Denna rörelse sker helt slumpmässigt, och ger atomerna en rörelseenergi. Vi kan tänka oss att atomerna satt ihop med fjädrar i molekylerna. Om vi sedan påverkar atomerna med en kraft som flyttar dem, så kommer fjädrarna att ”dras ut” och vi får en lägesenergi. Om vi sedan låter kraften försvinna kommer atomerna åka tillbaka till sina platser och lägesenergin kommer att ge mer rörelseenergi. Mer rörelseenergi ger som vi tidigare sagt en större rörelse, och en högre temperatur.
Värmeenergin är alltså summan av lägesenergin och rörelseenergin hos ett ämne.
För att tydliggöra hur värmeenergi bildas ska vi ta ett exempel. Du springer på gymnastiklektionen och snubblar på skosnörena, vilket gör att du ramlar och får ett svidande brännmärke. Nu tittar vi i detalj på vad som händer:
- Innan du ramlar har atomerna i din hud en viss värmeenergi på grund av att atomerna rör sig slumpmässigt. Denna värmeenergi är dock inte större än din hud klarar av och du får inga sår.
- När dit knä med fart slår emot golvet kommer hudens ojämnheter haka i golvets ojämnheter. Detta gör att atomerna i din hud dras från sina jämviktslägen och lägesenergin ökar.
- När du helt har bromsat in släpper golvet och huden varandra vilket gör att atomerna som dragits ut får ett tillskott av rörelseenergi. Den ökade atomrörelsen leder till en större värmeenergi som bränner hål på din hud och du får en mindre brännskada.
Uppvärmning och avkylning
När du värmer upp någonting, tillför du det du värmer upp energi. Denna energi kan du räkna på med formeln:


I formeln står (![]()
![]()
Specifik värmekapacitet
Du har säkert märkt att vissa föremål är mycket lättare att värma upp än andra. Detta beror på att det krävs olika mycket energi för att värma olika ämnen en grad. Nu ska vi undersöka hur mycket energi man måste tillföra ett ämne för att det ska värmas upp ett visst antal grader.
Vi börjar med några resonemang:
1. För det första kan man tänka sig att det krävs mer energi att värma upp en stor mängd av ett ämne än en liten. Det bör krävas mer energi att värma upp 1000 kilo vatten än 1 kilo vatten. Massan bör alltså spela in.
2. Det bör även spela roll hur många grader man värmer upp ett föremål.
3. Slutligen verkar det spela roll vilket ämne man värmer upp.
Det är faktiskt ovanstående tre faktorer som avgör hur mycket energi som krävs för uppvärmning:





I denna formel är (![]()
![]()
![]()
![]()
(![]()
![]()
(![]()
![]()
![]()
Observera att denna lag även gäller för avsvalning, då blir energimängden den energi som avges när ett ämne kyls ner ett visst antal grader.
En viktig regel
Det som gör allting mycket mer intressant är att:


Detta innebär att den energi som används för att värma upp ett ämne är lika stor som den energi som ämnet tagit upp för att uppvärmningen ska ske.
Exempel 1
Vi sätter en doppvärmare med effekten 200W i ett glas med 2,0 dl vatten under tio sekunder. Hur många grader stiger temperaturen?
Lösning
Energin som tillförs
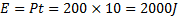
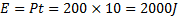
Energin som tas upp:





I detta fall är ![]()
![]()
![]()
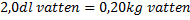
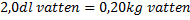
![]()
![]()
![]()
![]()
![]()
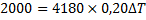
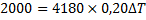
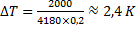
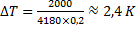
Notera att man i detta fall lika väl kan svara i grader Celsius då en temperaturförändring blir lika stor i Celsius och i Kelvin. Enda skillnaden mellan skalorna är var man satt nollpunkten.
Exempel 2
Du har kokat en kopp kaffe på 2,0 dl(0,20kg) till temperaturen 70 grader. Detta blandar du med 0,25 dl(0,025kg) mjölk av temperaturen 8,0 grader, hur hög blir sluttemperaturen i blandningen?
(OBS: Räkna med att både mjölk och kaffe har specifik värmekapacitet som vatten, dvs. ![]()
![]()
![]()
Lösning
Kaffet kommer ju svalna när mjölken hälls i, och det är alltså kaffet som avger energin. Om sluttemperaturen för blandningen är ![]()
![]()
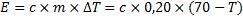
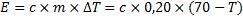
Detta för att temperaturskillnaden(![]()
![]()
![]()
Mjölkens temperatur kommer att öka, och det är alltså mjölken som tar upp energin:
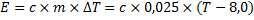
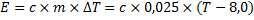
![]()
![]()
![]()


Genom att dividera med () får man:
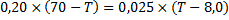
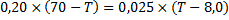
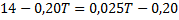
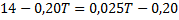
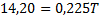
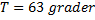
Svar: Sluttemperaturen är 63 grader Celsius.
Faser och fasövergångar
Hittills har vi fokuserat mycket på hur mycket energi det krävs för att värma upp ett visst ämne. Nu ska vi gå vidare och titta på vad det ur energisynpunkt händer när ett ämne övergår från en fas till en annan, exempelvis när vatten förångas eller fryser.
I bilden nedan ser vi hur temperaturförändringen ser ut när vi kontinuerligt värmer upp is från ursprungstemperaturen ![]()
![]()


Notera att vi får två områden där vi tillför mer energi utan att temperaturen ökar, detta kan verka konstigt men beror på att det kostar energi att smälta, respektive förånga vatten. Hur mycket energi det kostar att få ett ämne att övergå till en mer energirik fas är specifikt för varje ämne.
Med följande två formler kan man räkna på den energi som krävs för att smälta respektive förånga en viss massa (m) av ett visst ämne.
För smältning:



För förångning:
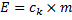
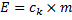
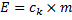
I dessa formler står (![]()
![]()
![]()
![]()
![]()
![]()
Notera att dessa två formler även fungerar för att räkna på hur mycket energi som frigörs vid övergång från flytande- till fast form respektive från gasform till flytande form.
Exempel
Du värmer 2,0 kg is med temperaturen ![]()
![]()
Lösning
Detta exempel tar upp i princip allt vi har talat om i detta kapitel så vakna till!
1. Först måste vi värma upp isen till noll grader, alltså en temperaturökning på 20 grader:





För is är den specifika värmekapaciteten(![]()
![]()
![]()
![]()
![]()
![]()


2. Sedan måste vi smälta 2,0 kg is:



![]()
![]()
![]()
![]()
![]()
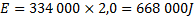
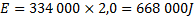
3. Vidare måste vi värma upp vattnet från 0 grader till 100 grader.





I detta fall använder vi den specifika värmekapaciteten(![]()
![]()
![]()
![]()
Den specifika värmekapaciteten för vatten är ![]()
![]()


4. Slutligen ska vi förånga vattnet, vars energiåtgång kan räknas ut med formeln:
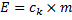
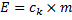
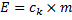
Den specifika ångbildningsentalpin(![]()
![]()
![]()
![]()
![]()
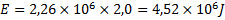
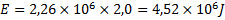
Den sammanlagda energiåtgången för hela processen blir:
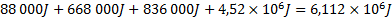
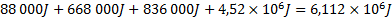
5. I uppgiften står det att en platta med 200W effekt ska ge denna energi:


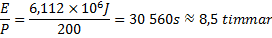
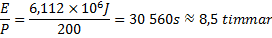
Svar: Det tar ungefär 8,5 timmar.

