Allmänt om analytisk kemi
Analytisk kemi är en gren inom kemin som fokuserar på att noggrant undersöka och förstå kemiska sammansättningar. Två centrala aspekter av analytisk kemi är kvalitativ analys och kvantitativ analys.
Kvalitativ analys innebär att fastställa vilka ämnen som finns i ett givet prov. Det handlar om att identifiera de olika kemiska komponenterna och deras proportioner för att få en översikt över sammansättningen. Denna metod fungerar som en viktig grund för att förstå de olika beståndsdelarna i en lösning eller substans.
Å andra sidan syftar kvantitativ analys till att mäta exakta mängder av specifika ämnen i ett prov. Detta innebär att bestämma koncentrationen eller mängden av ett visst ämne noggrant. Genom att kvantifiera det kemiska innehållet kan man få en detaljerad och numerisk förståelse av substansens sammansättning.
Intressant nog kan samma analysmetod ibland användas för både kvalitativ och kvantitativ analys, beroende på syftet med undersökningen. Det finns dock situationer där det är nödvändigt att tillämpa separata tekniker för att uppnå optimala resultat.
En oumbärlig del av analytisk kemi är användningen av separationsmetoder. Dessa metoder gör det möjligt att skilja olika ämnen åt i en blandning, vilket underlättar en individuell analys. Separationsprocessen är avgörande för att erhålla precisa och tillförlitliga resultat.
I sammanfattning är analytisk kemi en vetenskaplig disciplin som utforskar och förklarar kemiska sammansättningar genom tillämpning av olika metoder för att analysera och kvantifiera ämnen. Genom att kombinera kvalitativ och kvantitativ analys, samt använda separationsmetoder, möjliggör denna disciplin en djupgående förståelse av kemiska processer och sammansättningar.
Separationsmetoder
Separationsmetoder, som namnet antyder, är tekniker som används för att skilja olika ämnen från varandra. Dessa metoder utnyttjar olika egenskaper hos ämnena för att effektivt genomföra separationen.
En mängd olika egenskaper kan användas som grund för separation, inklusive storlek, laddning, bindningsstyrka till andra ämnen, magnetism, densitet, löslighet och mer. Genom att utnyttja dessa egenskaper kan man skapa metoder som möjliggör en selektiv och noggrann separation av olika komponenter i en blandning.
Intressant nog fungerar vissa separationsmetoder även som analytiska metoder. Det innebär att de inte bara separerar ämnena utan också ger information om vad som finns i provet och i vilken mängd. Denna dubbla funktion gör dessa metoder användbara både för att rena och isolera ämnen samt för att få insikt i deras sammansättning.
Sammanfattningsvis utgör separationsmetoder en mångfasetterad verktygslåda inom den analytiska kemin, som möjliggör både separation och karakterisering av olika ämnen i komplexa blandningar. Deras flexibilitet gör dem oumbärliga inom laboratoriearbete och bidrar till att öka förståelsen av olika kemiska processer och sammansättningar.
Kromatografi
Kromatografi är en separationsmetod som utnyttjar ämnenas löslighet i olika faser. Det är viktigt att förstå att kromatografin i sig själv inte kan vara vare sig kvalitativ eller kvantitativ. För att utföra mätningar på ett prov kräver kromatografi att den kopplas till andra tekniker. Denna kombination möjliggör inte bara en effektiv separation av ämnen utan ger också möjlighet till detaljerade analyser av sammansättningen och mängden av de komponenter som ingår i provet.
Kromatografisk teori
Alla kromatografiska metoder har en stationär fas och en mobil fas som inte löser sig i varandra. Den stationära fasen är stillastående, medan den mobila fasen rör sig på något sätt. Fördelningen av ämnen mellan de två faserna beskrivs med fördelningsjämvikt, som beskrivs med storheten KD. KD står för fördelningskoefficient (också känt som distributionskoefficient, fördelningskonstant eller distributionskonstant), och definieras enligt IUPAC som:
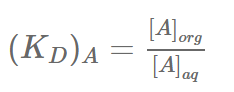
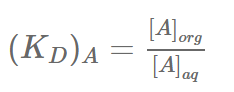
KD beskriver fördelningen mellan en organisk fas och en vattenfas. Det fungerar på samma sätt om man vill beskriva en fördelning mellan exempelvis en stationär fas och en mobil fas i kromatografi.
Separation
Vid kromatografi separeras olika ämnen på grund av att de löser sig olika bra i en av faserna. En molekyl som löser sig bra i den stationära fasen kommer ibland att stanna upp och binda denna, innan den vandrar vidare i den mobila fasen. Alla molekyler av samma ämne har ungefär lika stor chans att stanna ett kortare tag och binda den stationära fasen, vilket gör att de rör sig långsammare än den mobila fasen. En molekyl som löser sig bra i den mobila fasen kommer inte i samma grad att binda till den stationära fasen, vilket gör att den vandrar med ungefär samma hastighet som den mobila fasen.
Om vi stoppar in två ämnen samtidigt i en kolonn med mobil fas som långsamt rinner över en stationär fas (vätskekromatografi), och om ämne 1 löser sig bättre i den stationära fasen och ämne 2 löser sig bättre i den mobila fasen, så kommer ämne 2 att komma ut snabbt ur kolonnen då den följer med den mobila fasen. Ämne 1 binder hellre till den stationära fasen och dess hastighet genom kolonnen kommer att bromsas. På detta sätt kan vi separera ämnen från varandra. De stationära och mobila faserna kan varieras beroende på vad det är vi vill separera för något. Några exempel på kromatografiska metoder som vi kommer att tala mer om är:
- Vätskekromatografi (Tunnskiktskromatografi och HPLC)
- Gaskromatografi.
Elektrofores
Elektrofores är en separationsmetod som bygger på rörelsen av laddade partiklar, såsom molekyler eller joner, under påverkan av ett elektriskt fält. Denna metod kan tillämpas både kvantitativt och kvalitativt som en analysmetod.
Mera precist kan elektrofores användas för att separera partiklar utifrån olika egenskaper, såsom storlek, laddning eller bindningsstyrka till specifika molekyler eller joner. Denna flexibilitet gör elektrofores till en kraftfull teknik inom vetenskap och laboratoriearbete, där den möjliggör både karakterisering och kvantifiering av olika ämnen i prov.
Isoelektriska punkten
Isoelektriska punkten beskriver det pH-värde där en molekyl, såsom en aminosyra eller ett protein, inte har någon nettoladdning. Laddningen förändras i förhållande till pH på grund av upptag eller frisättning av vätejoner.
Förkortningen för isoelektrisk punkt är Ip (inom gymnasiekemin) eller pI (vanligt inom kemin). Enligt rekommendationer från IUPAC (International Union of Pure and Applied Chemistry) bör beteckningen pH(I) användas. I denna artikel kommer vi att använda pH(I) i enlighet med riktlinjerna.
Nyttan av isoelektrisk punkt
Isoelektriska punkten, en nyckelaspekt inom analytisk kemi och särskilt inom biokemin, har många tillämpningar. Vid elektrofores, en avancerad teknik inom analytisk kemi, rör sig molekyler under påverkan av ett elektriskt fält. Denna metod möjliggör separation och karakterisering av molekyler baserat på deras laddning och andra egenskaper.
Under elektrofores kommer molekyler vandra tills de når sin isoelektriska punkt, där de inte längre har någon nettoladdning. Vid denna punkt påverkar inte det elektriska fältet längre molekylen, och den stannar på ett specifikt ställe jämfört med andra molekyler. Den isoelektriska punkten är av särskild betydelse i biokemin, där den används för att karakterisera och separera biomolekyler som proteiner och aminosyror.
En fascinerande konsekvens av att nå isoelektrisk punkt är att molekylerna, nu utan nettoladdning, tenderar att klumpa ihop sig genom hydrofoba interaktioner. Särskilt när det gäller zwitterjoner, små molekyler med både positiv och negativ laddning samtidigt, leder detta ofta till att molekylerna fälls ut. Detta fenomen är nära kopplat till pH-värdet i miljön, och särskilt när molekylerna innehåller sura eller basiska grupper påverkas deras löslighet.
Sammanfattningsvis illustrerar isoelektriska punkten och dess tillämpningar inom elektrofores den djupgående förståelsen av kemiska processer och sammansättningar som analytisk kemi erbjuder.
Isoelektrisk punkt för aminosyror
pH(I) för olika aminosyror finns definierat i olika uppslagsverk och behöver inte beräknas. Vi kan illustrera hur en aminosyra reagerar vid olika pH-nivåer.
Denna variation i aminosyrans laddning beroende på omgivande pH-värden illustrerar hur dess struktur anpassar sig för att bibehålla en elektrisk neutralitet vid olika surhetsgrader.
Allmänt om titrering
Titrering utgör en fundamental gren inom analytisk kemi och representerar en kvantitativ analysmetod som systematiskt tillämpas för att bestämma koncentrationen av ett ämne i en lösning med okänd koncentration. Den spelar en oumbärlig roll när man strävar efter att erhålla exakta och pålitliga data om mängden av ett specifikt ämne i en given substans. Inom analytisk kemi är titrering särskilt användbar för en detaljerad karaktärisering av olika kemiska komponenter.
Tillämpningar av titrering sträcker sig över olika områden, inklusive mätning av C-vitaminhalten i appelsinjuice, bestämning av ättiksyra-koncentrationen i en flaska ättika och kvantifiering av metalljoner i ett dricksvattenprov. Dessa exempel belyser det breda spektrum av tillämpningar inom vilka titrering kan användas för att få insikter i kemiska sammansättningar och koncentrationer.
Vid utförandet av titrering innebär processen att gradvis tillsätta en känd mängd av en reagenslösning till den okända lösningen. Detta fortsätter tills en kemisk reaktion når fullständig neutralitet, vilket markerar ekvivalenspunkten. Inom analytisk kemi möjliggör denna metod noggrann beräkning av koncentrationen hos det sökta ämnet.
Sammanfattningsvis utgör titrering en viktig metod inom analytisk kemi, och dess tillämpningar sträcker sig över olika områden där exakt kunskap om koncentrationer är av betydelse för att förstå och karakterisera olika kemiska substanser.
Allmänt utförande
Principen för en typisk titrering är följande:
- Ta ett exakt mätprov av den okända lösningen (titranden) och överför det till en e-kolv. Till exempel kan provet vara 5.00 mL ättika med okänd koncentration.
- För att få information behöver man använda en känd lösning (titrator eller titrant) med känd koncentration av ett ämne som kan reagera med det intressanta ämnet. För ättika kan en 1.00 M NaOH-lösning vara ett passande val av känd lösning.
- Häll den kända lösningen i en byrett. En byrett med en kran används för att droppa i den kända lösningen gradvis, och dess noggranna gradering gör det möjligt att hålla koll på den exakta mängden som tillsatts.
- Tillsätt den kända lösningen försiktigt i e-kolven samtidigt som du rör om. Övervaka reaktionen med en indikator och fortsätt tills indikatorn visar att reaktionen har skett fullständigt (ekvivalenspunkten), vilket oftast markeras av en färgändring.
- Notera den volym av den kända lösningen som krävdes, till exempel 13.03 mL.
- Använd reaktionsformeln och känt information om koncentrationsberäkningar och stökiometri för att beräkna den okända koncentrationen. För ättiksyran (CH3COOH+NaOH⟶CH3COONa+H2O), där molförhållandet är 1:1, motsvarar 13.03 mL 1.00 M NaOH ungefär 0.01303 mol NaOH, vilket motsvarar 0.01303 mol ättiksyra i det okända provet. Genom att dividera med 5.00 mL får vi fram att den okända koncentrationen är 2.61 M.
Några felkällor vid titrering
Fel i titreringsexperimentet kan uppstå av olika anledningar och påverka resultaten. Här är några möjliga felkällor:
- Fel volym av den okända lösningen: Om provvolymen är felaktig, som i exemplet där du pipetterade 5.05 mL ättika istället för 5.00 mL, kommer koncentrationen av det sökta ämnet att beräknas felaktigt.
- Felaktig koncentration av den kända lösningen: Om koncentrationen av den kända lösningen är felaktig, som i exemplet där natriumhydroxiden hade en koncentration av 1.92 M istället för 2.00 M, kommer resultaten att vara inkorrekta.
- Felavläsning av byretten: Om byretten inte avläses korrekt, som i exemplet där det verkade som om 12.95 mL NaOH hade tillsatts, men faktiskt var 13.05 mL, kommer volymen av den kända lösningen att vara felaktig, vilket påverkar beräkningarna.
- Felaktig tolkning av indikatorn: Om indikatorn inte korrekt visar att reaktionen har skett fullständigt, och du avslutar titreringen vid fel punkt, kommer beräkningarna av koncentrationen att vara felaktiga.
- Det är viktigt att minimera dessa felkällor genom att noggrant följa titreringsprotokollet och dubbelkolla mätningar och avläsningar för att få pålitliga och precisa resultat.

