Atomen är väldigt liten. Vet du HUR liten?
Atomens historia
Vi tänkte börja med att berätta lite om de människor som under historien har arbetat för att nå fram till den atommodell vi har idag.
Antiken
Under antiken nämndes för första gången atomen. Det var Demokritos som beskrev atomen som den minsta beståndsdelen, och han namngav den därför atom som betyder odelbar på grekiska.
1600-talet
Boyle presenterade under detta århundrade den första uppdelningen mellan grundämnen och kemiska föreningar. Han insåg att vissa ämnen verkade kunna delas upp i beståndsdelar medan andra inte kunde det.
1800-talet
Under detta århundrade fortsatte undersökningen av ämnen som inte kan delas upp, och många fler grundämnen upptäcktes.
1860-talet
Mendelejev introducerar det periodiska systemet. I detta delar han upp grundämnena efter deras egenskaper och genom att det bildas luckor i systemet så kan han förutsäga vilka egenskaper de grundämnen som ännu inte identfierats bör ha. Utifrån detta upptäcks många nya grundämnen.
1890-talet
Thompson upptäcker elektronen, som alltså är en del av atomkärnan. I och med detta krossar han teorin om att atomen är odelbar, och den minsta beståndsdelen.
Thompson presenterade en egen atommodell, som ibland kallas för russinkakemodellen:
Denna går ut på att atomen är positivt laddad, men den har negativt laddade elektroner(russin) inbakad i den.
1911
Ernest Rutherford gjorde detta år ett experiment där han sköt heliumkärnor mot en guldfolie. Det visade då sig att de flesta heliumkärnorna gick rakt igenom folien, medan vissa vek av och några enstaka studsade tillbaka. Med detta visade Rutherford att atomerna främst består av tomrum. Annars skulle ju fler heliumkärnor ha studsat tillbaka.
Idag vet vi att atomen är i storleksordningen 10-10m medan atomkärnan är i storleksordningen 10-15m.
1913
Neils Bohr kommer detta år och förbättrar Rutherfords atommodell genom att säga att elektronerna rör sig i vissa bestämda banor runt atomkärnan. Enligt denna modell har varje elektronbana en viss energinivå. När atomen tillförs energi kan elektroner hoppa utåt till energirikare banor. När de hoppar tillbaka kommer det strålas ut energi av en våglängd som motsvarar den energiskillnad som finns mellan de bägge elektronbanorna. Om våglängden ligger inom det område vi kan se så strålas det ut synligt ljus.
Energinivåer
Enligt Bohrs modell ligger alltså elektronerna i olika energinivåer(elektronbanor). När atomen tillförs energi(exciteras)så kommer en atom att kunna nå en högre energinivå. Den kommer sedan förr eller senare att falla tillbaka spontant (deexciteras) till sin ursprungliga energinivå. Då strålar atomen ut en foton motsvarande den energi som skiljer mellan de två energinivåerna.
Detta kan illustreras med ett energinivådiagram:
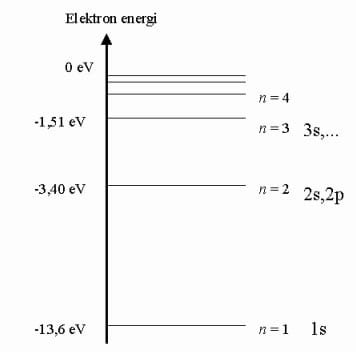

För väte finns en speciell formel som beskriver hur hög energi de olika energinivåerna har. Denna visas nedan:


Väteatomens energinivåer(En) är alltså negativa.
Observera att man i denna formel använder enheten elektronvolt(eV). Energin i elektronvolt får man genom att dela energin i Joule med elementarladdningen som är på 1,602×10-19 J.
När En blir större än noll har man uppnått joniseringsenergin. Detta innebär att atomen har fått så mycket energi att en elektron kan göra sig fri från den. För väte är joniseringsenergin alltså 13,6eV.
Fotonabsorbtion
För att en foton ska kunna absorberas av en atom krävs att fotonens energi precis överensstämmer med excitationsenergin, det vill säga energin mellan två energinivåer. Om denna energin är ΔE så kan sägas att:


Vid deexcitationen kommer en annan likadan foton att sändas ut.
Undantaget är om den inkommande fotonens energi överstiger joniseringsenergin. Då kommer den frigjorda elektronen bära med sig överskottsenergin i form av rörelseenergi.
Andra sätt att få excitation
- Partikelbombardemang. Detta innebär att man låter en partikel krocka med atomen så att den på så sätt får energi. Här måste inte den krockande partikeln ha samma energi som skillnaden mellan energinivåerna då partikeln kan åka iväg med överskottsenergin.
- Ett annat sätt är att tillföra värme och på så sätt inducera en excitation av atomen.
Kvanttal och det periodiska systemet (lite överkurs)
Nu på senare tid har man insett att elektroner inte beter sig riktigt så enkelt som Bohr visade. Det har senare påvisat att varje elektron beter sig på sitt eget sätt, de har sina egna kvanttalsuppsättningar som beskrivs mer nedan.
Elektronerna befinner sig för det första i olika skal. Skalen betecknas n.
Dessutom finns det underskal, som varje skal har. Dessa betecknas l.
Beteckningen ml beskriver var elektronen befinner sig. Det är nämligen så att elektronerna inte rör sig i en bestämd bana, och att de snarare har ett område där det är sannolikt att de befinner sig.
Den sista egenskapen elektronen kan ha kallas för spinn. Observera att elektronerna inte spinner fysiskt. Detta är mer en beskrivning av om elektronerna dras mot pluspol eller minuspol i ett magnetfält. Beteckningen är ms.
Röntgenspektrum
Röntgenstrålningen har en väldigt typiskt kurva när det gäller intensitet på olika våglängder.


Som ni ser har vi först ett kontinuerligt spektrum för att sedan få två skarpa toppar, eller så kallade spektrallinjer.
Ett röntgenspektrum uppkommer genom att man låter en elektron från något av de inre skalen exciteras. Då kommer en annan elektron och tar den lediga platsen. Detta gör att det skickas ut en röntgenfoton.

