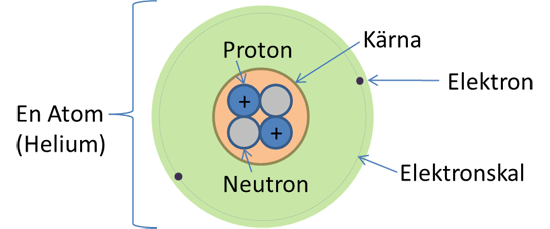
Bohrs atommodell
I gymnasiekemin är förståelsen för atomens uppbyggnad central, och en välkänd modell som används för att förklara dess struktur är Bohrs atommodell. Denna modell, trots att den utgör en förenkling av den verkliga komplexiteten, är särskilt användbar inom kemin för att förklara fundamentala aspekter av atomens funktion. Här följer en översikt över atomens uppbyggnad, presenterad genom en informativ film.
Atomens kärna utgörs av protoner och neutroner, medan elektronerna kretsar i olika elektronskal runt denna kärna.
Protonen bär en positiv elementarladdning, medan elektronen bär en negativ elementarladdning. Neutronen är oladdad.
Inom atomfysiken är det grundläggande att förstå att det alltid finns lika många protoner som elektroner i en atom. Om dessa antal avviker skapas en jon av atomarten.
Atomens uppbyggnad möjliggörs av neutronernas roll i att hålla ihop de positivt laddade protonerna i kärnan genom stark växelverkan. Utan denna kraft skulle protonerna repelleras på grund av deras liknande positiva laddning. Antalet neutroner kan variera i en atom med ett specifikt antal protoner, men oftast finns det ungefär lika många neutroner som protoner.
För att mäta massan hos atomens beståndsdelar används den atomära massenheten (u). En proton har massan 1,007 u, en neutron har massan 1,009 u, och en elektron har massan 0,000549 u. En jämförelse av dessa partiklars massor ger en ytterligare inblick i atomens uppbyggnad.
Denna grundläggande förståelse för atomens uppbyggnad är avgörande inom kemin och atomfysiken, och det är viktigt att fortsätta utforska detta ämne för att fördjupa kunskapen om kemiska reaktioner och andra kemiska fenomen. För ytterligare information om isotoper och andra aspekter av atomens uppbyggnad, rekommenderas det att utforska relevanta artiklar och resurser inom området.

| Symbol | Massa | Laddning | |
| Proton | p+ | 1,0073 u | +1 |
| Elektron | e− | 0,000549 u | −1 |
| Neutron | n | 1,0087 u | 0 |
Allmänt om elektroner
Elektronens egenskaper
Elektroner är elementarpartiklar med en negativ elementarladdning och minimal massa. Som viktiga beståndsdelar av atomens uppbyggnad spelar de en central roll i dess egenskaper.
I motsats till elektroner består protoner och neutroner av mindre komponenter kallade kvarkar. Denna komplexa interaktion av elementarpartiklar är nyckeln till att förstå atomens struktur.
En jämförelse mellan de olika komponenterna i en atom ger insikter om deras roller. Atomens uppbyggnad, inklusive elektroner, protoner och neutroner, är avgörande för att förklara fysikaliska och kemiska fenomen. Fördjupad kunskap om atomens uppbyggnad bidrar till en bättre förståelse av grundläggande principer inom atomfysik och kemi.
| Symbol | Massa | Laddning | |
| Proton | p+ | 1,0073 u | +1 |
| Elektron | e− | 0,000549 u | −1 |
| Neutron | n | 1,0087 u | 0 |
I atomens uppbyggnad är antalet elektroner lika med antalet protoner i kärnan. Elektronerna, negativt laddade, avstöter varandra, vilket leder till att de fördelas för att minimera avståndet mellan dem. Denna dynamik påverkar kemiska bindningar och atomens stabilitet.
Samtidigt attraheras elektronerna av protonernas positiva laddning i kärnan, skapande en subtil balans mellan avstötning och attraktion. Förståelsen av denna balans är central för atomens uppbyggnad och dess påverkan på kemiska interaktioner.
Elektroner finns i elektronskal


In atomens uppbyggnad rör sig elektronerna extremt snabbt runt atomkärnan. Förutspå exakt var de befinner sig vid ett givet tillfälle är principiellt omöjligt; istället kan man beskriva en sannolikhet för deras plats. Elektronerna bildar ett sfäriskt elektronmoln runt atomen, och det finns platser där de har högre sannolikhet att befinna sig, vilket kallas för elektronskal enligt Bohrs atommodell. Speciellt betydelsefulla är valenselektronerna, de som befinner sig i det yttersta elektronskalet, då de starkt påverkar atomens egenskaper inom atomens uppbyggnad.
Elektronskal
Ett mycket viktig del av hur atomerna beter sig beror på hur deras elektronskal ser ut. Ett elektronskal beskrivs i Bohrs atommodell som ett skal runt kärnan på ett visst avstånd där det får plats ett specifikt antal elektroner som cirkulerar runt kärnan.
Elektronskalens namn
Elektronskalen räknas från kärnan och utåt. Det innersta skalet kallas för K-skalet, nästa skal kallas för L-skalet, och därefter kommer M-skalet. På samma sätt fortsätter man i alfabetet tills man når Q-skalet, vilket är det yttsta skalet man behandlar i modellen.
Det yttersta elektronskalet som det finns elektroner i kallas för valensskalet. Det är elektronerna i detta skal som ger atomen dess speciella egenskaper.


Antalet elektroner per skal
Antalet e– (elektroner) som maximalt kan finnas i ett skal kan beräknas med denna enkla formel: Antale−=2⋅n2Antale−=2⋅n2,
där n är elektronskalets nummer. K-skalet är det första (innersta) skalet, alltså har det 1 som nummer. Via formeln konstaterar vi att det max kan finnas två elektroner i det skalet. På samma sätt kan vi konstatera att det får plats 8 elektroner i L-skalet (n = 2) och 18 elektroner i M-skalet (n = 3).
Hur elektronerna fördelas i skal
Inom atomens uppbyggnad placeras elektroner generellt sett i de inre elektronskalen före de yttre. Detta mönster uppstår eftersom elektronerna, ju närmare de är kärnan, får mindre energi. Begreppet “hur elektronskal fylls” refererar till den teoretiska processen där elektroner skulle tas bort från atomen och sättas tillbaka en efter en, och det ger inblickar i atomens uppbyggnad. Det är genom detta sätt att fylla elektronskalen som atomens uppbyggnad och energinivåer förstås och beskrivs.
Elektronkonfiguration
Elektronkonfigurationen, baserad på Bohrs atommodell, ger en detaljerad beskrivning av atomens uppbyggnad genom att specificera vilka elektronskal elektronerna befinner sig i. Denna notering av elektronkonfigurationen ger insikt i hur elektronerna fyller de olika skal som omger atomkärnan, och det är central information för att förstå atomens uppbyggnad baserat på Bohrs atommodell.Nedan ses ett exempel:
| K | L | M | N | |
| 20 p+ | 2 | 8 | 8 | 2 |
Kalcium (Ca) har en atomstruktur med 20 protoner och motsvarande 20 elektroner. Elektronerna fylls i atomens skal enligt följande:
- Först fylls K-skalet med 2 elektroner, vilket gör K-skalet fullt.
- Därefter fylls L-skalet med 8 elektroner och blir därmed fullt.
- M-skalet innehåller 8 elektroner men är inte helt fullt.
- Det yttersta skalet, N-skalet, innehåller 2 elektroner.
Denna strukturbeskrivning ger insikt i hur elektronerna är organiserade runt kalciumatomen och bidrar till förståelsen av atomens uppbyggnad.
Ett nytt exempel ses nedan:
| K | L | M | N | |
| 30 p+ | 2 | 8 | 18 | 2 |
Zink (Zn) har en atomstruktur med 30 elektroner. Elektronerna fylls i atomens skal enligt följande:
- K-skalet och L-skalet fylls först helt.
- M-skalet är också helt fyllt med elektroner.
- Det yttersta skalet, N-skalet, innehåller 2 elektroner.
Denna strukturbeskrivning ger insikt i hur elektronerna är organiserade runt zinkatomen och bidrar till förståelsen av atomens uppbyggnad.
Riktlinjer för hur elektronskalen fylls
Elektronfyllnaden i atomer, enligt Hunds regel, ger oss en inblick i atomens uppbyggnad genom följande mönster:
(1) K-skalet fylls till 2 (fullt). (2) L-skalet fylls till 8 (fullt). (3) M-skalet fylls till 8 (ej fullt).
Dessa riktlinjer gäller för atomer upp till 18 elektroner och ger en grund för förståelsen av atomens uppbyggnad. Vidare blir elektronfyllnaden mer komplext definierad.
(4) N-skalet fylls till ungefär 2 elektroner (ej fullt). (5) M-skalet fylls till 18 elektroner (därefter fullt). (6) N-skalet fylls till 8 elektroner (ej fullt).
För att förstå mer om atomens uppbyggnad rekommenderas att utforska ämnet längre, där yttre elektronskal fylls innan inre elektronskal. Bohrs atommodell, trots att den är en förenkling, ger oss en användbar grund för att förstå elektronernas arrangemang, även om en fullständig förklaring kräver en övergång till orbitaler, vilket dock inte ingår i gymnasiekemin.
Excitation
Genom att tillföra energi kan en elektron exciteras, vilket innebär att den hoppar från sitt vanliga elektronskal till ett skal längre bort från atomkärnan. Denna process ger oss insikter om energinivåerna i atomens uppbyggnad. Trots att elektronen innehåller mer energi kommer den förr eller senare att återgå till sitt ursprungliga elektronskal med lägre energinivå. Under denna återgång avges överskottsenergi i form av ljus eller värme. Fenomenet av excitation och återgång ger därmed en förståelse för dynamiken i atomens uppbyggnad och dess samband med energi.
Valenselektroner
I valensskalet, det yttersta elektronskalet som ingår i atomens uppbyggnad och innehåller elektroner, finns det 8 eller färre elektroner. K-skalet har en maxkapacitet på 2 elektroner som valensskal inom atomens uppbyggnad. Trots att elektronskalet kan rymma fler än 8 elektroner fylls det endast till 8 om det agerar som valensskal, vilket kallas för oktettregeln och är en viktig del av atomens uppbyggnad.
Antalet valenselektroner är avgörande för atomens egenskaper inom atomens uppbyggnad, och atomer med samma antal valenselektroner uppvisar liknande beteenden, särskilt när det gäller bindningar. En atom eller jon med 8 valenselektroner anses ha ett ädelgasskal, vilket gör den stabilt och motståndskraftig mot reaktioner med andra ämnen inom atomens uppbyggnad.
Vid övergångsmetaller fylls de inre elektronskalen i stället för det yttre, en viktig aspekt av atomens uppbyggnad. Även om övergångsmetaller har fler totala elektroner än de efterföljande har de inte nödvändigtvis fler valenselektroner.
Atomer tenderar spontant att reagera för att uppnå ett fullt valensskal inom atomens uppbyggnad, vilket leder till ökad energistabilitet. Detta förklarar många av de kemiska egenskaperna och reaktiviteten hos olika ämnen inom atomens uppbyggnad.
Elektronformel
För att få insikt i atomens uppbyggnad och antalet valenselektroner används ofta en elektronformel. Elektronformeln ger en visuell representation av hur valenselektronerna är fördelade runt atomens uppbyggnad.
För att skapa en elektronformel börjar du med att skriva det kemiska tecknet för atomen. Atomens fyra sidor – vänster, över, höger och under – har plats för totalt två elektroner vardera.
Beroende på antalet valenselektroner som atomen har, placerar man först en elektron åt respektive håll. Därefter tillförs ytterligare en elektron på varje plats. Detta illustreras visuellt, som i exemplet nedan:


Elektronformler kan ses som en förenklad variant av lewisstrukturer för molekyler, vilket vi går igenom senare.
Oktettregeln
Oktettregeln postulerar att atomens uppbyggnad är mest stabil när det yttersta elektronskalet, ofta kallat ädelgasskal, innehåller 8 valenselektroner. Denna stabilitet kan uppnås genom hela elektronövergångar där joner bildas eller genom kovalenta bindningar där elektroner delas mellan atomerna i bindningen.
Det är viktigt att förstå att oktettregeln utgör en observation snarare än en självständig kemisk drivkraft. Reaktioner som resulterar i mer stabila kemiska föreningar leder oftast (men inte alltid) till ädelgasskal enligt oktettregeln. Det finns dock ämnen som uppfyller oktettregeln men inte är stabila, som Li⁷⁻, och ämnen som är stabila trots att de inte uppfyller oktettregeln, som sulfatjonen SO₄²⁻.
Undantag
Ett undantag i oktettregeln finns för de minsta atomerna. K-skalet kan inte innehålla fler än två valenselektroner, vilket gör att det där istället tillämpas duettregeln. I övrigt är principen densamma.
Hur oktettregeln används
Oktettregeln används främst som ett praktiskt verktyg för att snabbt bestämma laddningar för atomjoner och för att avgöra antalet möjliga kovalenta bindningar mellan atomer, vilket är viktigt för att förstå atomens uppbyggnad. För att använda oktettregeln effektivt är det fördelaktigt att ha tillgång till ett periodiskt system. Det underlättar snabba beräkningar och bedömningar av atomers elektronarrangemang vid bildandet av joner och kovalenta bindningar.
Grundämnen
Begreppet “grundämne” kan förstås på två olika sätt, och båda belyser viktiga aspekter av atomens uppbyggnad och kemiska sammansättning:
- En typ av atom med en specifik mängd protoner i atomkärnan: Här syftar grundämne på en enskild atomtyp, kännetecknad av ett specifikt antal protoner i atomkärnan. Denna egenskap definierar atomens kemiska identitet och dess plats i det periodiska systemet, vilket är avgörande för att förstå atomens uppbyggnad.
- Ett ämne bestående av enbart en atomtyp: Å andra sidan betecknar grundämne ett ämne som består uteslutande av atomer av samma typ. Det innebär att alla atomer i det aktuella ämnet har identiskt antal protoner, vilket skapar enhetlighet i dess kemiska sammansättning och ger inblick i atomens uppbyggnad.
För att ytterligare utforska och förklara dessa aspekter går vi igenom dem detaljerat i de följande rubrikerna.
1. En typ av atom som innehåller en viss mängd protoner i atomkärnan (atomslag)
Begreppet “grundämne” tolkas vanligtvis som “atomslag”, vilket refererar till en av de ungefär 120 identifierade typerna av atomer. Varje atomslag karakteriseras av ett unikt atomnummer, baserat på antalet protoner i dess kärna och ger därmed en viktig insikt i atomens uppbyggnad.
För att ytterligare identifiera och hänvisa till dessa atomslag används kemiska tecken, förkortningar av deras fullständiga namn. Några exempel på grundämnen eller atomslag inkluderar:
- Väte (H)
- Helium (He)
- Syre (O)
- Kol (C)
Dessa exempel ger en överblick över mångfalden av atomslag och illustrerar hur kemiska tecken används för att representera dem, samtidigt som de ger insikter om atomens uppbyggnad.
| Antal protoner | Namn | Kemiskt tecken |
| 1 | Väte | H |
| 2 | Helium | He |
| 6 | Kol | C |
| 20 | Kalcium | Ca |
När man skriver ett kemiskt tecken innehåller det flera viktiga uppgifter relaterade till atomens uppbyggnad:
- I det nedre vänstra hörnet kan man notera atomnumret, vilket representerar antalet protoner i atomkärnan. Detta utelämnas oftast eftersom atomnumret redan indirekt inkluderas i det kemiska tecknet.
- I det övre vänstra hörnet återfinns masstalet, som är summan av antalet protoner och neutroner.
- I det övre högra hörnet kan man inkludera laddningen, speciellt om det rör sig om en jon. Laddningen som noteras är nettoladdningen, särskilt relevant om det finns flera laddade atomer med samma beteckning.
- I det nedre högra hörnet kan man skriva in antalet atomer, vilket är särskilt användbart om det finns fler av samma atomslag. Om antalet atomer är 1 utelämnas siffran oftast. Denna information ger en översikt över förekomsten av det specifika atomslaget och bidrar till förståelsen av atomens uppbyggnad.


Notera att alla dessa delar inte visas på samma gång. Vid undersökning av enskilda atomer/joner kan informationen om masstal och atomnummer förekomma och ge insikter om atomens uppbyggnad. Å andra sidan, vid betraktande av kemiska ämnen och föreningar, återfinns oftast endast informationen som skrivs till höger, det vill säga laddning och antal atomer. Denna anpassning av information beroende på kontexten underlättar förståelsen av atomens uppbyggnad och dess roll i olika kemiska sammanhang.
2. Ett ämne som består endast av en typ av atomer
Den andra definitionen av grundämne är ett kemiskt ämne som består endast av ett atomslag. Ett exempel på detta är atomslaget syre (O). En enskild syreatom är inte stabil i detta sammanhang; istället bildar syre grundämnet O2, ofta kallat syrgas. Den sänkta tvåan efter den kemiska beteckningen indikerar att syrgasen består av två syreatomer. Denna illustration exemplifierar hur enskilda atomer kan förena sig och bilda stabila grundämnen, vilket är avgörande för att förstå atomens uppbyggnad och dess förekomst i olika kemiska former.
Sammanfattning
Ett grundämne kan alltså syfta på antingen atomslag, vilket är vilken typ av atomer det handlar om, eller grundämne som i kemiskt ämne som består av endast ett atomslag.
Om man säger ”grundämnet natrium”, kan man alltså syfta på antingen natriumatomer i allmänhet (atomslaget), eller metallen natrium (kemiskt ämne som endast består av natriumatomer).
För att skilja mellan de två använder man ofta ordet atomslag för den första tolkningen av grundämne, för att undvika den förvirring som uppstår pga de dubbla betydelserna. Denna distinktion är viktig för att få en klar förståelse av atomens uppbyggnad och dess representation i olika kemiska sammanhang. En tydlig begreppsdifferentiering underlättar för studenter att förstå atomens uppbyggnad på ett precist sätt.
Isotoper
Som tidigare nämnts om Bohrs atommodell kan antalet neutroner variera inom en specifik atomtyp. När två atomer har identiskt antal protoner men skiljer sig i antalet neutroner, benämns de som isotoper av samma grundämne. Denna egenskap är karakteristisk för isotoper och bidrar till en djupare förståelse av atomens uppbyggnad och varietet inom elementen. Genom att studera isotoper kan forskare och studenter utforska de olika former som ett grundämne kan anta, vilket är relevant för många kemiska och fysikaliska sammanhang.
Att beskriva en isotop
När man vill beskriva en specifik isotop av ett grundämne skrivs masstalet upphöjt på vänster sida om atombeteckningen. Masstalet representerar summan av antalet protoner och neutroner i en atom, där antalet protoner kan skrivas nedsänkt på vänster sida om atombeteckningen. För att illustrera detta, ta exemplet med en isotop av klor som har 17 protoner och 18 neutroner, vilket resulterar i masstalet.
Normalt sett anses informationen om antalet protoner vara överflödigt, eftersom alla kloratomer innehåller 17 protoner. Om antalet protoner hade varit annorlunda, hade atombeteckningen förändrats. Därför skrivs oftast som nedan.
För att verbalt beskriva isotopen används namnet “klor-35,” vilket refererar till antalet neutroner i atomens uppbyggnad. Likaså finns en variant av klor med 17 protoner och 20 neutroner, kallad “klor-37.” Ett annat exempel är “kol-14,” som används vid datering av gamla föremål och ger insikter om atomens uppbyggnad. Vid den verbala beskrivningen av isotopen placeras atomslaget först och masstalet sist. Denna praxis underlättar förståelsen och kommunikationen kring atomens uppbyggnad och dess olika varianter.
Många isotoper av samma grundämne
Ett och samma grundämne har vanligtvis flera isotoper, vilka skiljer sig åt i massa på grund av olika antal neutroner i atomens uppbyggnad.
Majoriteten av de isotoper vi stöter på i vardagen är stabila och förändras inte över tiden. Om vi placerar atomerna i en låda, förhindrar deras interaktion med varandra eller omgivningen, kan vi efter 1 miljon år plocka ut samma atomer utan att de har genomgått förändringar.
Det är viktigt att notera att när man anger massan för ett grundämne, såsom i det periodiska systemet, representerar det ett genomsnitt av alla förekommande isotoper. Denna information ger en grundläggande förståelse för atomens uppbyggnad och egenskaper. Nästa artikel kommer att fördjupa sig i ämnet atommassa och ge ytterligare insikter om atomens uppbyggnad.
Radioaktiv isotop
En icke-stabil isotop av ett grundämne kallas för en radioaktiv isotop. Många av de tunga grundämnena innehåller exempelvis inga stabila isotoper alls, utan sönderfaller alltid spontant i en viss hastighet efter att de har skapats. Under sönderfallet sänder de ut olika former av strålning, samtidigt som det bildas isotoper av andra grundämnen. Strålningen består ofta av dels någon form av partiklar (t.ex. α-strålning, som består av helium-4-kärnor, eller β-strålning, som består av elektroner) kombinerat med elektromagnetiska vågor (t.ex. γ-strålning).
Halveringstid
Ett viktigt begrepp för att förstå radioaktiva isotoper, och därmed även atomens uppbyggnad, är halveringstid. Halveringstid är den tid det tar tills bara hälften av originalämnet återstår. Om halveringstiden för ett ämne är 100 år kommer endast hälften av den radioaktiva isotopen att finnas kvar efter 100 år, och resten kommer att ha sönderfallit till stabilare grundämnen. Det är värt att notera att halveringstiden kan vara kortare än en sekund, vilket innebär att det finns en bred variation i halveringstider för olika radioaktiva isotoper. Denna information är central för att bedöma stabiliteten och hållbarheten hos radioaktiva material och har betydelse för ämnen som påverkar atomens uppbyggnad.
Ett exempel på en radioaktiv isotop
In atomens uppbyggnad är det värt att notera hur isotoper spelar en roll. Ett exemplar av en svagt radioaktiv isotop är kol-14, vilket vi tidigare nämnt i denna artikel. Kol-14, med en halveringstid på cirka 5700 år, är inte stabilt och genomgår sönderfall. Processen där kol-14 bildas sker i atmosfären genom påverkan av kosmiska partiklar. Isotopen inkorporeras i levande organismer genom fotosyntesen, där koldioxid omvandlas. Efter att ett organiskt material dör, kommer det inte längre att vara synkroniserat med den aktuella nivån av kol-14 i levande organismer, eftersom kol-14 successivt sönderfaller. Genom att mäta halterna av kol-14 i gamla föremål kan forskare beräkna hur lång tid det har gått sedan de slutade att utbyta kol med omgivningen. Denna metod, känd som kol-14-datering, är ett användbart verktyg inom arkeologi och geovetenskap.
Atommassa
Vid betraktande av individuella atomer och molekyler stöter vi på utmaningen att beskriva deras massa i kilogram (kg) eller gram (g) på grund av de extremt små massorna. Det är inte praktiskt att säga att en specifik atom, som kol-12 i detta fall, har massan 1,99⋅10−26 kg eller 1,99⋅10−23 g. Dessa siffror ger oss ingen verklig uppfattning om atomens storlek.
För att beskriva massan hos atomer och molekyler används atomära massenheten (u). 1 u definieras som 1/12 av massan av kol-12 atomen, vilket ungefär motsvarar 1,7⋅10−27 kg. Fördelen med enheten u är att den gör jämförelser mellan atomer enklare.
Genom att använda atommassan kan vi snabbt avgöra att magnesium, med en atomvikt på 24,305 u, väger ungefär dubbelt så mycket som kol, som har en atomvikt på 12,011 u. Denna jämförelse ger insikt om de relativa massorna hos olika atomer. I studiet av atomens uppbyggnad är det avgörande att förstå och tillämpa begreppet atomära massenheten för att underlätta beskrivningen av atomers massa och jämförelse mellan olika atomer.
Dalton
Enheten Dalton (Da), som ibland används som en synonym till atomära massenheten (u), ger oss möjligheten att jämföra massan hos olika atomer och molekyler på ett praktiskt sätt i studiet av atomens uppbyggnad.
Dalton används främst vid beskrivning av stora atommassor, och det är möjligt att använda SI-prefix framför Dalton i dessa sammanhang, vilket ger ytterligare flexibilitet. Till exempel kan massan på ett protein uttryckas som 14 kDa (kiloDalton), men inte som 14 ku (kiloatomära massenheter).
För att konvertera mellan atomära massenheter (u) och Dalton (Da) är det enkelt att byta enhet på ditt mätetal: 1 u = 1 Da och 1 Da = 1 u. Denna konvertering är värdefull för forskning om atomens uppbyggnad och möjliggör enklare hantering av olika atommassenheter.
Atomslag och deras atommassa
I det periodiska systemet observerar man att atommassorna för grundämnen ibland anges som icke-heltal. Denna företeelse kan förklaras genom tre huvudsakliga faktorer.
För det första är masstalet för en atom inte identiskt med dess atommassa. Även om protoner och neutroner har ungefär samma massa (cirka 1 u), är de inte exakt likvärdiga.
För det andra kan avvikelsen från heltal bero på förekomsten av flera isotoper av ett grundämne. När det finns olika naturligt förekommande isotoper används den genomsnittliga atommassan för att återspegla deras variation.
Den tredje faktorn är att en atoms totala massa inte alltid motsvarar summan av dess beståndsdelars massor. Denna avvikelse relaterar till den speciella relativitetsteorin (E = mc²), en aspekt som inte fördjupas inom ramen för gymnasiekemin. Därmed kan förekomsten av icke-heltal i atommassor förklaras genom att beakta dessa tre faktorer. I studiet av atomens uppbyggnad är det viktigt att förstå dessa komplexa samband och de teoretiska grundvalarna för att tolka atommassor och deras representation i det periodiska systemet.
Beräkna atommassan för ett grundämne
För att beräkna atommassan för ett grundämne, givet dess isotoper, används följande formel:
Genomsnittlig atommassa=atommassa(isotop1)⋅relativ fo¨rekomst(isotop1)+atommassa(isotop2)⋅relativ fo¨rekomst(isotop2)+…Genomsnittlig atommassa=atommassa(isotop1)⋅relativ fo¨rekomst(isotop1)+atommassa(isotop2)⋅relativ fo¨rekomst(isotop2)+…
För att illustrera detta används klor som exempel. Klor förekommer i två isotoper: klor-35 (masstal 35, cirka 35 u) med 76 % förekomst och klor-37 (masstal 37, cirka 37 u) med 24 % förekomst. Den genomsnittliga atommassan för klor beräknas således enligt:
35⋅0,76+37⋅0,24=35,48 u35⋅0,76+37⋅0,24=35,48u
Denna beräkning ger en siffra som är relativt nära de 35,45 u som vanligtvis används i det periodiska systemet. Om de exakta värdena för atommassan för klor-35 (34,969 u) och klor-37 (36,965 u) hade använts, skulle det avrundade svaret ha blivit 35,45 u. I gymnasiekemin brukar man dock oftast utgå från masstalet för att göra en ungefärlig beräkning, eftersom de exakta isotopmassorna vanligtvis inte anges i läromaterialen. Förståelsen av hur man beräknar den genomsnittliga atommassan för ett grundämne är viktig för att tolka och använda informationen i det periodiska systemet. För att förstå atomens uppbyggnad är det nödvändigt att ha insikt i hur isotoper och atommassor relaterar till varandra.
Periodiska systemet
Det periodiska systemet utgör en strukturerad tabell som organiserar atomslagen i kemin. För att tolka ett periodiskt system och förstå hur atomslagen är indelade i grupper (vertikalt) och perioder (horisontellt) med hänsyn till deras gemensamma egenskaper, är det rekommenderat att ha ett periodiskt system till hands. Du kan använda det som finns tillgängligt på den här länken.
I det periodiska systemet har varje atomslag tilldelats en specifik plats eller ruta. För att illustrera detta, låt oss ta exemplet kol.
I detta exempel är kol (C) placerat i den fjärde perioden och fjärde gruppen i det periodiska systemet. Genom att studera systemets uppbyggnad kan man observera mönster och samband mellan atomslag med liknande egenskaper. Att förstå det periodiska systemet är grundläggande för att kunna tolka och använda informationen om atomslag och deras egenskaper inom kemin. Detta koncept är viktigt för att få insikt i atomens uppbyggnad och dess betydelse inom den kemiska vetenskapen. För att utforska atomens uppbyggnad vidare, rekommenderas det att studera de specifika egenskaperna hos olika atomslag och deras placering i det periodiska systemet.


Informationen i varje atomslags ruta kan variera mellan olika periodiska system. Ibland inkluderas detaljer som antalet elektroner i varje skal, och detta kan variera särskilt mellan Internet-baserade system och pappersbaserade tabeller. Online-plattformar tenderar att erbjuda mer detaljerad information om atomens uppbyggnad.
Atomslagen klassificeras ofta i tre huvudgrupper: metaller, icke-metaller och halvmetaller. Dessa kategorier markeras ibland med olika färger, men det är viktigt att notera att färgkodningen kan variera beroende på den specifika illustrationen eller det periodiska systemet.
Metaller är ämnen med karakteristiska egenskaper, såsom god elektrisk ledningsförmåga och blank yta. Icke-metaller saknar metallernas egenskaper och kan vara i form av gaser eller bilda kovalenta bindningar för att skapa större molekyler. Begreppet halvmetaller används lite svepande, eftersom deras egenskaper inte är helt metalliska eller icke-metalliska. Halvmetaller har ofta metalliska egenskaper vid vissa temperaturer eller tryckförhållanden, vilket ger ytterligare insikter i atomens uppbyggnad.
Det är värt att notera att dessa kategorier ger en översikt över atomslagens egenskaper, och deras exakta uppdelning och färgkodning kan variera beroende på presentationen. Att förstå dessa kategorier är viktigt för att få insikt i atomens uppbyggnad och de olika egenskaper som är karakteristiska för olika grupper av atomer.
För ytterligare fördjupning och källor om atomens uppbyggnad och periodiska systemet, rekommenderas att konsultera pålitliga källor såsom kemiböcker, vetenskapliga artiklar och akademiska resurser som Periodiska systemet – KTH och Kemiskt lexikon – Naturvetenskap.
Grupper och perioder
Det periodiska systemet, organiserat i grupper (vertikala kolumner) och perioder (horisontella rader), ger en strukturerad översikt över atomernas egenskaper baserat på deras elektronarrangemang och elektronskal. Inom samma grupp delar atomslagen gemensamma egenskaper och har tendenser att bilda liknande typer av kemiska bindningar, medan atomer inom samma period delar liknande antal elektronskal, påverkande storlek och bindningsförmåga.
För att förstå atomens uppbyggnad och det periodiska systemets roll inom kemin, är det värdefullt att utforska relevanta källor som kemilitteratur och vetenskapliga artiklar. För en djupare inblick i atomens uppbyggnad kan man fördjupa sig i teorier om elektronkonfiguration och orbitalsystem.

