Kemiska formler är avgörande för att kunna förstå och beskriva sammansättningen av olika kemiska ämnen. Genom kemiska formler kan man få en översiktlig bild av hur atomer och molekyler är sammansatta och vilka proportioner de förekommer i.
En kemisk formel används för att beskriva sammansättningen hos atomer, joner, molekyler och salter. Kemiska formler kan vara empiriska, vilket innebär en simpel beskrivning av proportionerna av olika atomer/joner i saltet eller molekylen. De kan också vara summaformler, som ger en exakt angivelse på antalet atomer som molekylen består av.
För att förstå den verkliga strukturen av en molekyl kan man använda sig av strukturformler och lewis-strukturer. Med hjälp av dessa kemiska formler kan man få en visuell bild av hur atomerna är arrangerade och hur elektronerna delas mellan dem.
Det är också viktigt att kunna tolka de olika symbolerna och siffrorna i en kemisk formel. En nedsänkt siffra indikerar att det finns ett visst antal atomer av det slaget i formeln, medan en upphöjd siffra med ett plus eller minus efter indikerar laddningen på jonen.
Kemiska formler är alltså ovärderliga verktyg för att kunna kommunicera och förstå den kemiska sammansättningen av olika ämnen. Genom att kunna tolka och använda kemiska formler kan man öka sin förståelse för den omgivande världens kemiska processer.


Atomslagens ordning
Hur atomslagen placeras i en kemisk formel är en viktig del av att förstå sammansättningen av olika ämnen. Den informationen ges sällan, men är avgörande för att tolka kemiska formler korrekt.
För att bestämma ordningen på atomslagen i en formel kan man använda sig av två olika metoder: binär nomenklatur och Hill-systemet. Binär nomenklatur används främst för oorganiska föreningar, medan Hill-systemet används för organiska föreningar.
Generellt sett kan man använda sig av vissa tumregler för att placera atomslagen i en formel. Dessa tumregler fungerar för de flesta föreningar inom gymnasiekemin och kan ge en indikation på hur atomslagen är ordnade. Kemiska formler är ovärderliga när det kommer till att förstå den kemiska sammansättningen av olika ämnen, och kunskapen om hur atomslagen placeras är en central del av denna förståelse.
Oorganiska föreningar (binär nomenklatur)
- Det minst elektronegativa ämnet placeras först i formeln, och därefter allting annat i bokstavsordning.
- Om vi har flera katjoner (positiva joner) eller anjoner (negativa joner) placeras dessa i bokstavsordning.
- Ett surt väte (ett väte som kan släppa från molekylen som då är en syra) placeras först i föreningen, men efter positiva joner. Detta väte räknas inte som det minst elektronegativa ämnet i föreningen. Detta är bara relevant när det finns mer än två atomslag i molekylen.
- Molekylära joner skrivs på samma sätt som allt annat. Minst elektronegativa ämnet först, och därefter allt annat i bokstavsordning. Sura väten placeras först i formeln enligt föregående punkt.
- Molekylära joner (joner som består av mer än en atom) rankas enligt det första grundämnet i föreningen vid bokstavsordning.
Även om det finns regler för ordningen på atomslag i kemiska formler, är det viktigt att notera att det finns undantag från dessa regler, speciellt när det kommer till namngivning av föreningar. Trots regler som reglerar ordningen på atomslagen i formeln, har vissa föreningar bibehållit sina traditionella namn.
Ett exempel är ammoniak (NH3), vars kemiska formel egentligen borde vara H3NH3N enligt ordningsreglerna. Emellertid har traditionen bibehållit ordningen som NH3. Detsamma gäller för ammoniumjonen (NH4+), vars korrekta formel enligt ordningsreglerna borde vara H4N+. Trots detta bibehålls den traditionella formen NH4+.
Det är viktigt att förstå att trots att det finns regler för ordningen på atomslagen i kemiska formler, finns det undantag som får sin legitimitet genom tradition och historiska namngivningskonventioner. Detta visar att vissa föreningar har behållit sina namn trots att de inte helt följer de strikta ordningsreglerna för atomslag i kemiska formler.
Exempel
HClHCl Väteklorid (saltsyra). Väte är här det minst elektronegativa atomslaget, och placeras därmed först i formeln.
N2ON2O Dikvävemonoxid (lustgas). Kväve är här det minst elektronegativa atomslaget, och placeras därmed först i formeln.
H2CO3H2CO3 Divätekarbonat (Kolsyra). Vi har här en förening som kan betraktas som ett salt, men är inte ett organiskt ämne då karbonatjonen räknas som ett oorganiskt ämne. Vätena är sura, så de placeras först.
NaHCO3NaHCO3 Natriumbikarbonat. Natrium är en positiv jon, och vätekarbonat är den negativa jonen. Vätet är surt i vätekarbonatjonen, så vätet placeras före karbonatdelen av jonen.
ClFClF Klormonofluorid. Klor som är minst elektronegativt placeras först i formeln.
Organiska föreningar (Hill-systemet)
- I organiska föreningar (föreningar som innehåller kol) placeras alltid C på fösta plats och H på andra plats i formeln.
- Resterande atomslag ordnas i bokstavsordning.
Exempel
CH3ClCH3Cl
CH2ClFCH2ClF
CHBrClICHBrClI
CBrClFICBrClFI
C2H2BrCl2F2C2H2BrCl2F2
Undantag
I en empirisk formel åsidosätts strukturella detaljer och man följer helt enkelt de etablerade reglerna för att fastställa atomernas ordning. Å andra sidan kan en summaformel, även känd som molekylformel, utökas med strukturell information, vilket ger läsaren mer detaljerad information. I dessa fall är det viktigt att inte bara följa de vanliga prioriteringsreglerna eller den bokstavsordning man normalt gör utan att skriva atomslagen på ett sätt som återspeglar deras struktur eller funktionella grupper. Ett exempel är att ättiksyra skrivs som CH3COOH istället för C2H4O2.
När man använder sådana utökade summaformler börjar man närma sig textbaserade strukturformler, vilket är ett ämne som kan utforskas vidare i artikeln om strukturformler. Genom att införa sådana struktur- och funktionella informationer är det möjligt att förbättra förståelsen av molekylär struktur och interaktioner och överföra betydelsefull information till läsaren.
Empirisk formel
En empirisk formel ger en beskrivning av proportionerna mellan de olika atomslagen i en molekyl, men den ger ingen information om molekylens storlek, utan endast förhållandet mellan atomerna. För att bestämma de exakta värdena för atomerna i en molekyl kan analytisk kemi användas för att fastställa de relativa beståndsdelarna i molekylen.
Ett exempel på detta är glukos, som har summaformeln C6H12O6. Dess empiriska formel är CH2O eftersom de nedsänkta siffrorna vid varje atom allihop kunde delas med 6. Denna typ av kemisk analys och jämförelse ger viktig information om molekylernas sammansättning och är avgörande för att förstå deras egenskaper och beteende i kemiska reaktioner.
Hur man räknar med empirisk formel
Många uppgifter angående empirisk formel består i att man får veta hur mycket av varje atomslag som finns i molekylen uttryckt i massprocent. Du ska sedan bestämma empiriska formeln för molekylen.
Lösningsmetod:
1. Förutsätt att du har 100 g av ämnet.
2. Använd massprocenten för att bestämma hur stor massa du har av respektive atomslag.
3. Räkna ut substansmängderna av respektive atomslag.
4. Jämför substansmängderna med varandra genom att dela alla substansmängder med den minsta substansmängden, och få fram förhållandet.
5. Om du inte får fram heltal (exempelvis 1,33 eller 1,5) så kan du multiplicera upp talen i den empiriska formeln tills du har heltal.
Summaformel
En summaformel, även känd som molekylformel, är en exakt angivelse av antalet atomer av varje slag som finns i en molekyl av ett ämne. Till skillnad från den empiriska formeln, som endast anger förhållanden mellan de olika atomslagen, innehåller summaformeln både information om förhållandena mellan atomslagen och den faktiska mängden av respektive atomslag i ämnet. Det är dessa uppgifter som ger en tydlig bild av molekylens sammansättning och struktur, vilket är avgörande för att förstå ämnets egenskaper och beteende i kemiska processer.
En summaformel kan innehålla strukturell information
I en summaformel finns det möjlighet att inkludera information om strukturen på ämnet, särskilt när det gäller organiska föreningar. Ett exempel på detta är att man kan separera ut en karboxylsyra-grupp genom att skriva den på slutet av strukturformeln som -COOH. På detta sätt skapar man vad som kan kallas en förenklad strukturformel. Mer information om detta kommer att behandlas i kommande artiklar. Genom att inkludera sådana detaljer i summaformler blir det möjligt att få en mer detaljerad förståelse av molekylens struktur, vilket är avgörande för att förstå dess egenskaper och beteende i kemiska reaktioner.
Hur man räknar med summaformel
Många uppgifter angående summaformel består i att man få veta massprocenten av respektive atomslag i molekylen, samt dess molmassa.
Lösningsmetod:
1. Förutsätt att du har en massa lika stor som molmassan.
2. Använd massprocenten för att bestämma hur stor massa du har av respektive atomslag.
3. Räkna ut substansmängderna av respektive atomslag.
4. Substansmängden är lika med de nedsänkta siffrorna i molekylformeln.
Strukturformel
En strukturformel är en förenklad representation av hur atomer är kovalent bundna till varandra. Det finns olika varianter av strukturformler, men i denna artikel ska vi översiktligt gå igenom de delar som finns med i alla strukturformler.
För att förstå en strukturformel måste man först känna till att varje atom är förkortad med en specifik förkortning som återfinns i det periodiska systemet. Om du tittar på det periodiska systemet kan du se förkortningar för alla atomer och deras en- eller tvåbokstavskoder, samt deras placering i olika grupper. Att förstå dessa grundläggande detaljer är avgörande för att kunna tolka och arbeta med strukturformler.
Olika atomer kan binda olika mycket
Baserat på i vilken grupp atomen ligger i på det periodiska systemet kan man bedöma hur många kovalenta bindningar den kan skapa.
- Atomerna i grupp 1 (alkalimetallerna) brukar inte binda kovalent. Ett undantag är väte (H), som kan skapa en kovalent bindning.
- Atomerna i grupp 2 (alkaliska jordartsmetaller) binder inte kovalent.
- Atomerna i grupp 3-12 (övergångsmetallerna) binder inte kovalent.
- Atomerna i grupp 13 (borgruppen) binder vanligtvis inte kovalent. Ett undantag är bor (B), som kan skapa tre kovalenta bindningar.
- Atomerna i grupp 14 (kolgruppen) binder ofta kovalent. Kol (C) och kisel (Si) skapar vanligtvis fyra kovalenta bindningar.
- Atomerna i grupp 15 (kvävegruppen) binder ofta kovalent. Kväve (N) och fosfor (P) skapar vanligtvis tre kovalenta bindningar.
- Atomerna i grupp 16 (syregruppen) binder ofta kovalent. Syre (O) och svavel (S) skapar vanligtvis två kovalenta bindningar.
- Atomerna i grupp 17 (halogenerna) binder ofta kovalent. Fluor (F), klor (Cl), brom (Br) och jod (I) skapar vanligtvis en kovalent bindning.
- Atomerna i grupp 18 (ädelgaserna) har ett fullt yttre elektronskal, och binder inte kovalent.
Hur en bindning ser ut


Att skriva ut alla väteatomer i en strukturformel kan vara tidskrävande, och därför komprimeras ofta väte till att skrivas på samma ställe som kolatomerna. När väten komprimeras återges det som på bilden nedan. Den övre och undre strukturen beskriver samma förening. Bindningarna mellan kolatomerna bevaras, men väteatomerna placeras på ett sätt som de brukar presenteras i reaktionsformler.
Observera att på den vänstra kolatomen skrivs väteatomerna till vänster istället för till höger om kolatomen. Detta görs för att göra strukturformeln mer realistisk och för att tydligt visa var kolskelettet avslutas på vänster sida
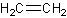
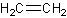
Två andra grupper som ofta förkortas i strukturformler är amingruppen och karboxylgruppen
Amingruppen förkortas -NH2 om den sitter på ett kol som pekar åt höger, uppåt eller nedåt, och H2N- om den sitter på ett kol som är längst till vänster. I bilden motsvarar R en valfri resterande molekyl.
Karboxylgruppen förkortas -COOH om den sitter på ett kol som pekar åt höger, uppåt eller nedåt, och HOOC- om den sitter på ett kol som är längst till vänster.


Tre parallella streck mellan två atomer betyder att det är en trippelbindning, som består av totalt sex elektroner. En trippelbindning innehåller mer energi än en dubbelbindning, och kan reagera med andra ämnen på diverse sätt. I bilden till höger kan du se föreningen etyn, vilken innehåller en trippelbindning mellan de två kolatomerna. Kol kan som tidigare nämnt ha totalt fyra bindningar, och tre är upptagna i trippelbindningen. Den kvarvarande bindningen går till en väteatom.
Grupper komprimeras


Det tar givetvis en hel del tid att skriva ut alla väten i en strukturformel, och av den anledningen komprimerar man ofta väte till att skrivas på samma ställe som kolatomen finns. När man komprimerar väten ser det ut som på bilden till höger. Den övre och undre strukturen beskriver samma förening. Bindningarna mellan kolatomerna finns kvar, men man har stoppat in vätena på ett sätt som de brukar skrivas i reaktionsformler.
Notera att man på kolatomen till vänster skriver vätena till vänster istället för till höger om kolatomen. Detta görs för att få strukturformeln att se mer verklighetstrogen ut, och att man enkelt kan se var kolskelettet tar slut på vänster sida.


Två andra strukturer som ofta förkortas är amingruppen och karboxylgruppen.
Amingruppen förkortas som -NH2 när den är kopplad till ett kolatom som pekar åt höger, uppåt eller nedåt, och som H2N- när den sitter på ett kol som är längst till vänster. I dessa förkortade strukturformler representerar R en valfri resterande molekyl.
Karboxylgruppen förkortas som -COOH när den är kopplad till ett kolatom som pekar åt höger, uppåt eller nedåt, och som HOOC- när den sitter på ett kol som är längst till vänster.
Även laddning skrivs ut
I en strukturformel är det inte alltid enkelt att förutsätta att alla atomer är oladdade. Om en atom på något sätt blir laddad måste detta återspeglas i strukturformeln.
Laddningar uppstår ofta när föreningen fungerar som en syra eller bas och därmed har antingen fått eller avgett en vätejon (H+), vilket kan leda till att vissa atomer blir laddade.
Generellt sett kan man säga att:
- Om en atom har fler kovalenta bindningar än den vanligtvis ska ha, blir den positivt laddad.
- Om en atom har färre kovalenta bindningar än den vanligtvis ska ha, blir den negativt laddad.
Dessa påståenden gäller för både syror och baser, samt för andra förekomster av laddade föreningar. Därför är det viktigt att korrekt representera laddade atomer i en strukturformel för att exakt återspegla föreningens elektroniska egenskaper.


I bilden nedan kan du se vad som händer med ättiksyra när den deprotoneras. Det kvarvarande syret har endast en bindning, vilket betyder att det har en färre än det brukar ha och därmed har en negativ laddning. Laddningen visas vid den laddade atomen, och i detta fall återges det med ett minustecken vid syret längst till höger.
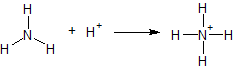
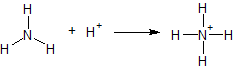
På samma sätt blir en atom positivt laddad om den har fler bindningar än den brukar ha. Detta kan enkelt visas genom en basreaktion, där ammoniak tar upp en proton och omvandlas till ammonium. Eftersom kväve då har fyra bindningar istället för dess vanliga tre, blir det positivt laddat. Laddningen återges med ett plustecken vid kväveatomen.

