Syror
En syra är ett ämne som är ökar koncentrationen av H+ i en vattenlösning. Syror kan lösa upp oädla metaller, och är i allmänhet frätande.
Detta är en standardreaktion för en syra (saltsyra löses i vatten):
H2O+HCl⟶H3O++Cl−.H2O+HCl⟶H3O++Cl−.
H3O+ kallas för oxoniumjoner, och det är dessa som ger vatten dess sura egenskaper. Ju mer H3O+ som finns i vattnet, desto mindre är pH.
Protolysering och deprotonering
När en syra lämnar ifrån sig en proton till ett annat ämne, säger man att syran är protolyserad, eller att syran har protolyserat. Ett annat sätt att beskriva det på är att syran är deprotonerad, eller att syran har deprotonerats.
Syrors egenskaper
En syra är frätande om koncentrationen av H+ är stor nog. Orsaken till detta är att protonövergångar till målmaterialet bryter ned eller gör det mer vattenlösligt.
På vår tunga finns receptorer som känner av koncentrationen av H+ så vi kan känna hur pass surt det vi äter är.
Starka syror
När man löser en stark syra i vatten avger de flesta syramolekylerna sina protoner till vattnet.
Exempel på starka syror:
– Väteklorid (saltsyra): HCl.
– Svavelsyra: H2SO4.
– Salpetersyra: HNO3.
Alla dessa syror har i någon mån förmågan att lösa upp metaller. Guld kan exempelvis inte lösas av någon av dessa syror om de bara får verka för sig. Om man däremot blandar saltsyra och salpetersyra resulterar detta i något som kallas för kungsvatten, vilket löser även guld.
Svavelsyra är en tvåprotonig syra, vilket betyder att den kan avge protoner i två steg. Först avges en proton från den starka svavelsyran. Kvar finns sedan en vätesulfatjon, HSO4– vilket är en svag syra, men även en jon.
Svaga syror
När man löser en svag syra i vatten avger bara en del av syramolekylerna sina protoner till vattnet. En vanlig siffra på hur många procent av molekylerna i en svag syra som avger sina protoner är < 2%. pH blir inte lika lågt som om man hade löst en en stark syra i vattnet.
Exempel på svaga syror:
– Kolsyra: H2CO3.
– Ättikssyra: CH3COOH (förkortas ofta HAc, där Ac kommer av engelskans acetic acid).
En svag syra gör att pH i en lösning inte ökar så mycket som den borde om man på något sätt försöker öka pH. Då protoner försvinner från lösningen så lossnar protoner från den svaga syran, och pH ökar långsammare.
Metalljoner som syror
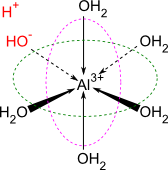

Metalljoner kan i många fall fungera som syror. Vad som händer är att metalljonen binder upp vattenmolekyler, och en av dessa släpper ifrån sig en vätejon.
Ett exempel är aluminiumjonen, som i vattenlösning först bildar komplex med vattenmolekyler, och därefter kan deprotonera en av vattenmolekylerna för att öka surheten i lösningen:
[Al(H2O)6]3+⇌[Al(H2O)5OH]2++H+.[Al(H2O)6]3+⇌[Al(H2O)5OH]2++H+.
En syras styrka
För att beskriva hur stark en syra är så använder man sig av något som kallas för syrakonstanten, vilken skrivs som Ka. På grund av de små värdena minuslogaritmerar man Ka, och pKa ger oss siffror i en omfattning vi enklare kan arbeta med. Mer om detta under titeln ”syrakonstanten” i menyn till vänster. Ju mindre pKa är, ju mer av syran protolyseras (ger ifrån sig protoner).
Vanliga syror och deras pKa
| Namn | Summaformel | pKa1 | pKa2 |
| Vatten | H2O | 15,74 | |
| Ättiksyra | CH3COOH eller HAc | 4,76 | |
| Kolsyra | H2CO3 | 3,60 | 10,33 |
| Salpetersyra | HNO3 | -1,4 | |
| Svavelsyra | H2SO4 | -3,0 | 2,0 |
| Saltsyra | HCl | -8,0 |
Baser
En bas är ett ämne som är benäget att ta upp protoner från andra ämnen i sin närhet. En bas måste ha ett fritt elektonpar för att kunna ta upp en proton.
Detta är en standardreaktion för en bas, natriumhydroxid löses i vatten:
NaOH(s)−→−H2ONa+(aq)+OH−(aq)NaOH(s)→H2ONa+(aq)+OH−(aq)
OH− kallas för hydroxidjoner, och det är dessa som ger vatten dess basiska egenskaper. Ju mer OH− det finns i en lösning, ju mindre H3O+ finns det, vilket betyder att pH ökar.
Basers egenskaper
En bas är frätande för det mesta som består av organisk vävnad. Om du får en bas på handen så känns den tvålig, och detta beror på att basen löser upp fettet i huden via basisk esterhydrolys, och bildar fettsyror i stil med de som finns i tvål.
När du arbetar med baser ska du alltid bära skyddsglasögon då baser otroligt snabbt kan förstöra ögonen, även i mindre koncentrationer.
Starka baser
Den enda relevanta starka basen vi går igenom i gymnasiekemin är natriumhydroxid NaOH. Då detta är en jonförening så sker ingen kemisk reaktion så som det gör med de starka syrorna som vi visade ovan, utan de löses bara ut i vattnet. I stort sett allt det natriumhydroxid som man lägger i vattnet löses också.
NaOH(s)−→−H2ONa+(aq)+OH−(aq)NaOH(s)→H2ONa+(aq)+OH−(aq)
Svaga baser
När man löser en svag bas i vatten tar bara en del av basmolekylerna upp protoner från vattnet. pH blir inte lika högt som om man hade löst en en stark bas i vattnet.
Exempel på en svag bas:
– Ammoniak: NH3NH3
NH3(aq)+H2O⇌NH+4(aq)+OH−(aq)NH3(aq)+H2O⇌NH4+(aq)+OH−(aq)
En svag bas gör att pH inte minskar så mycket som den borde om man på något sätt försöker minska pH. Då det dyker upp fler protoner i lösningen så tas de upp av den svaga basen, och pH sjunker långsamt.
Styrkan hos en bas
För att beskriva en bas kan man antingen använda baskontanten Kb för basen i sig eller syrakonstanten Ka för basens korresponderande syra. Att konsekvent använda sig av Ka ger den fördelen att man lätt kan jämföra styrkan på de olika syrorna. Om en bas och en syra blandas kan man lätt se vilken av syran eller basens korresponderande syra som kommer att vara protonerad.
Vanliga baser och deras pKb (och korresponderande syras pKa)
| Namn | Summaformel | pKb | Korresponderande syra | pKa för syran |
| Vatten | H2O | 15,7 | H3O+ | -1,7 |
| Ammoniak | NH3 | 4,75 | NH4+ | 9,25 |
| Hydroxidjoner | NaOH, KOH, etc. | -1,7 | H2O | 15,7 |
pH
Syror och baser har viktiga funktioner i kemiska reaktioner. För att greppa hur syror och baser fungerar bör man först lära sig vad pH är för något.
Vad är pH?
pH är ett mått på hur mycket oxoniumjoner H3O+ det finns i en lösning. Man brukar säga att pH-skalan sträcker sig från 0-14, men det finns tal både över och under dessa. H3O+ skrivs även ofta som H+ i kemiska sammanhang, detta på grund av att det bara är H+ som förflyttar sig och reagerar. Ju mer H3O+ som finns i vattnet, ju mindre är pH.
Hur beräknar man pH?
pH kan på ett förenklat sätt definieras såhär:
pH=−lg([H+]mol/dm3)pH=−lg([H+]mol/dm3)
Vad detta i praktiken betyder är att man tar minuslogaritmen av koncentrationen av H+ (eg. H3O+) för att beräkna pH. Att vi delar det hela med enheterna mol/dm3 har att göra med att pH inte har en enhet, och att vi därför måste göra oss av med enheten på vätejonskoncentrationen i formeln.
I destillerat 25-gradigt vatten finns det 10−7 mol/dm3 H+. Med andra ord är [H+] = 10−7 mol/dm3, och
pH=−lg(10−7)=7pH=−lg(10−7)=7
Hur beräknar man [H+] om man vet pH?
Det är bra om man kan beräkna pH, men det är ännu bättre om man även kan räkna ”baklänges” och ta reda på hur stor koncentration av vätejoner (oxoniumjoner) man har i lösningen. Detta görs med följande formel:
[H+]=10−pHmol/dm3[H+]=10−pHmol/dm3 vilken ofta skrivs som: [H+]=10−pH[H+]=10−pH
Viktiga formler
pH=−lg([H+]mol/dm3)pH=−lg([H+]mol/dm3) vilken ofta skrivs som: pH=−lg([H+])pH=−lg([H+]).
[H+]=10−pHmol/dm3[H+]=10−pHmol/dm3 vilken ofta skrivs som: [H+]=10−pH[H+]=10−pH.
Syra-baspar
Ett syra-baspar är de former som en bas respektive syra kan befinna sig i.
Syra⇌H++BasS���⇌�++���
För varje syra finns det en korresponderande bas. För varje bas finns det en korresponderande syra. Dessa två kallas för syra-baspar. Saltsyra HCl har kloridjonen Cl– som korresponderade bas. Ammoniak NH3 (en bas) har den korresponderande syran NH4+.
För enprotoniga syror gäller:
- En stark syra har oftast en svag korresponderande bas.
- En svag syra har oftast en stark korresponderade bas.
För baser gäller:
- En stark bas har oftast en svag korresponderande syra.
- En svag bas har oftast en stark korresponderade syra.
Syrabasreaktion
Det som kallas för syrabasreaktion är när det sker protonövergångar mellan två olika ämnen. Oftast är detta mellan en bas eller syra och vatten. Det viktiga är att det krävs två syrabaspar för att en syrabasreaktion ska se. Någonting måste ge bort en proton, och någonting måste ta emot den.
Syrakonstanten
När man räknar matematiskt på hur mycket av en syra som är protolyserad (har avlämnat sina protoner) använder man sig av syrakonstanten Ka. Syrakonstanten är kopplad till jämviktskontanten, och visar hur mycket av en syra som är protolyserad. För en svag syra kommer reaktionen att vara förskjuten åt vänster, och väldigt få av syramolekylerna har lämnat bort sina protoner. För en stark syra är reaktionen förskjuten åt höger, och få eller inga syramolekyler finns kvar som inte har lämnat ifrån sig sina protoner.
Syra+H2O⇌H3O++BasSyra+H2O⇌H3O++Bas
Ka=K×[H2O]=[H3O+]×[Bas][Syra]�a=�×[H2O]=[H3O+]×[Bas][Syra]
Man lägger in vattenkoncentrationen i Ka för att slippa ha med och dela med ett varje gång man räknar på det. Koncentrationen av vatten är dessutom i stort sett konstant i en vattenlösning.
Ka har därmed enheten mol/dm3.
- Om Ka är högt är det en stark syra.
- Om Ka är lågt är det en svag syra.
Man kan även minuslogaritmera Ka, och få ut pKa på en syra.
- Om pKa är högt är det en svag syra.
- Om pKa är lågt är det en stark syra.
Något som är viktigt att tänka på är att speciellt svaga syror fungerar som jämvikter. Om vi tillsätter en stark syra till lösningen kommer jämvikten för den svaga syran att förskjutas åt vänster, då den korresponderande basen på höger sida i reaktionsformeln tar upp protoner.
Syra+H2O⇌H3O++KorresponderandebasSyra+H2O⇌H3O++Korresponderandebas
Viktiga formler
Ka=[H3O+]×[Bas][Syra]�a=[H3O+]×[Bas][Syra]
pKa=−lg(Ka)p�a=−lg(�a)
Ka=10−pKa
Baskonstanten
När man vill räkna ut hur mycket hydroxidjoner som en bas har skapat i en lösning använder man sig av baskonstanten Kb.
Baskonstanten är kopplad till jämviktskonstanten vid en basreaktion, och visar hur mycket hydroxidjoner som skapas. För en svag bas kommer reaktionen att vara förskjuten åt vänster, och väldigt få av basmolekylerna har tagit upp protoner. För en stark bas är reaktionen förskjuten åt höger, och få eller inga av basmolekylerna finns kvar.
Bas+H2O⇌OH−+SyraBas+H2O⇌OH−+Syra
Kb=K×[H2O]=[OH−]×[Syra][Bas]�b=�×[H2O]=[OH−]×[Syra][Bas]
Man lägger in vattenkoncentrationen i Kb för att slippa ha med och dela med ett varje gång man räknar på det. Koncentrationen av vatten är dessutom i stort sett konstant i en vattenlösning.
Kb har därmed enheten mol/dm3.
- Om Kb är högt är det en stark bas.
- Om Kb är lågt är det en svag bas.
Man kan även minuslogaritmera Kb, och få ut pKb på en bas.
- Om pKb är högt är det en svag bas.
- Om pKb är lågt är det en stark bas.
Något som är viktigt att tänka på är att speciellt svaga baser fungerar som jämvikter. Om vi på något sätt höjer hydroxidjonskoncentrationen i lösningen kommer jämvikten för den svaga basen att förskjutas åt vänster, då den korresponderande syran på höger sida i reaktionsformeln ger ifrån sig protoner.
Bas+H2O⇌OH−+KorresponderandesyraBas+H2O⇌OH−+Korresponderandesyra
Det är väldigt ovanligt att man ser tabeller över baskonstanter. Detta beror på att Ka och Kb beskriver två besläktade egenskaper, och dessa kan kopplas ihop med hjälp av vattnets protolyskonstant. Sambandet är:
Ka⋅Kb=Kw�a⋅�b=�w
Vilket vi även kan skriva som:
pKa+pKb=pKwp�a+p�b=p�w
För en syra har vi en viss syrakonstant. Den korresponderande basens baskonstant kan beräknas via formlerna ovan.
Viktiga formler
Kb=[OH−]×[Syra][Bas]�b=[OH−]×[Syra][Bas]
pKb=−lg(Kb)p�b=−lg(�b)
Kb=10−pKb�b=10−p�b
Ka⋅Kb=Kw�a⋅�b=�w
pKa+pKb=pKw
Buffertlösning
En buffertlösning är en vattenlösning som vanligtvis innehåller en svag syra och dess korresponderande bas i någon proportion.
Funktionen av en buffertlösning är att hålla pH stabilt. Om pH i lösningen höjs kommer detta att kompenseras av att den svaga syran avger H+ och sänker pH igen. Om pH minskar kommer basen att ta upp H+ och pH ökar igen.
Beroende på vilken syra (och därmed också dess korresponderande bas) vi har i buffertsystemet, så varierar det pH som mest buffertkapacitet erhålls vid. Den optimala buffringen sker när vi har ett förhållande mellan syran och dess korresponderande bas som är 1:1. Vid detta förhållande är pH = pKa för syran, och därmed buffrar en bufferlösning bäst vid ett pH som är nära syrans pKa.
Buffertlösningar används inom många levande organismer, inkluderat människor för att reglera pH. I blodet har vi en buffertlösning som håller pH inom ett ganska snävt område som behövs för att vi ska överleva.
Syra-basberäkningar
Denna artikel är helt dedikerad till exempeluppgifter på syra-basberäkningar. Övningsuppgifterna är till för att du ska kunna tillämpa det du har lärt dig från resten av våra artiklar. Om du tycker att något typexempel saknas får du gärna kontakta oss. Titlarna är ordnade efter när man stöter på beräkningstyperna i gymnasiekemin.
Starka syror
Tänk på att:
- Starka syror protolyseras till 100 %.
- Du ofta använder formeln: pH=−lg([H+])pH=−lg([H+])
- Du ofta använder formeln: [H+]=10−pH[H+]=10−pH
- Du ofta använder formeln: n=c⋅V
ÖvningsuppgiftSvarLösning
Du har 0,05 mol HCl i en 1 dl lösning. Vad blir pH för lösningen?
HCl(aq)⟶H+(aq)+Cl−(aq)HCl(aq)⟶H+(aq)+Cl−(aq)
n(HCl)=0,05mol
n(HCl)=n(H+)
n(H+)=0,05mol
V=0,1dm3
c=nV=0,05mol0,1dm3=0,5mol/dm3
pH=−lg([H+])=−lg(0,5mol/dm3)=0,3pH=−lg([H+])=−lg(0,5mol/dm3)=0,3
ÖvningsuppgiftSvarLösning
Du mäter upp ett pH på 2.0 i en lösning. Vilken koncentration av vätejoner finns i lösningen?
[H+]=10−pHmol/dm3=10−2mol/dm3=0,01mol/dm3[H+]=10−pHmol/dm3=10−2mol/dm3=0,01mol/dm3
Starka baser
Tänk på att:
- I en stark bas kommer alla basmolekyler att delta i att öka koncentrationen av OH– i lösningen.
- Du ofta använder formeln: pOH=−lg([OH−])pOH=−lg([OH−])
- Du ofta använder formeln: [OH−]=10−pOH[OH−]=10−pOH
- Du ofta använder formeln: pH+pOH=14

