En grundläggande del inom kemin är hur bindningar mellan olika ämnen fungerar. Vi behandlar både bindningar inom ämnen (intramolekylära bindningar), mellan ämnen (intermolekylära bindningar), och varför dessa uppstår. I menyn till vänster kan ni se de artiklar vi har om ämnet.
Intramolekylära bindningar
Kemiska bindningar är avgörande för att förstå strukturen och egenskaperna hos olika ämnen. Intramolekylära bindningar är en viktig typ av kemisk bindning som påverkar molekylära strukturer. Dessa bindningar förekommer inom en molekyl och är ansvariga för att hålla samman atomer inom en specifik molekyl. Kemsika bindningar ger stabilitet till molekylen och kan vara av olika typer, såsom kovalenta bindningar eller joniska bindningar.
Jämfört med de intermolekylära bindningarna, som inträffar mellan olika molekyler, är intramolekylära bindningar mycket starkare eftersom de håller samman atomer inom samma molekyl. Denna starka bindning är avgörande för att upprätthålla strukturen hos molekylen och påverkar dess fysikaliska egenskaper. Exempel på ämnen med starka intramolekylära bindningar inkluderar vatten (H2O) med sina kovalenta bindningar och natriumklorid (NaCl) med sina joniska bindningar.
Typer av intramolekylära bindningar
- Jonbindning − där elektrostatisk attraktion mellan de olika laddade jonerna gör att de håller ihop i en kristallstruktur.
- Metallbindning − där elektroner delas i ett gemensamt elektronmoln.
- Kovalent bindning − där valenselektroner delas i så kallad elektronparbindning.
Jonbindning
En jon är en atom eller molekyl som har en elektrisk laddning på grund av att den antingen har för många eller för få elektroner jämfört med antalet protoner i kärnan. När joner av motsatt laddning kommer nära varandra, kommer de att attraheras av varandra på grund av den elektrostatiska kraften. Denna attraktion kallas för en jonbindning.
Jonbindningar är en viktig typ av kemisk bindning och är vanligt förekommande i salter och kristallina föreningar. Genom bildandet av jonbindningar kan joner sammankopplas för att bilda stabila föreningar. Till exempel, natriumjonen (Na+) och kloridjonen (Cl-) kommer att bilda en jonbindning för att skapa natriumklorid (NaCl), även känt som bordssalt.
Jonbindningar har en stark inverkan på egenskaperna hos många material och substanser. De påverkar bland annat smältpunkten, lösligheten och elektrisk ledningsförmåga. Dessutom är jonbindningar av stor betydelse för biologiska processer och spelar en avgörande roll i upprätthållandet av cellernas funktioner och struktur.
Joner sitter ihop som kristaller


Joner visar en tendens att binda till joner med motsatt laddning. Jonkristaller, såsom saltkristaller, bildas av dessa joner och har en kubisk struktur, vilket gör dem totalt sett laddningsneutrala. Ett exempel på en sådan kristall är NaCl, även känt som koksalt, vilken består av Na+ och Cl- joner. Varje natriumjon omges av 6 kloridjoner, medan varje kloridjon är omgiven av 6 natriumjoner. Denna 3D-struktur upprepas i en regelbunden mönster över hela kristallen, vilket ger upphov till dess jonkristallina karaktär. Ett exempel på en sådan struktur, här representerad av litiumfluorid, syns i bilden till höger.
Hur jonföreningar (salter) kombineras ihop kan du läsa mer om här.
Olika starka jonbindningar
Beroende på olika faktorer (vilka diskuteras här) kan styrkan hos jonbindningar variera. Starka jonbindningar resulterar i höga kok- och smältpunkter för saltet och gör det svårare att lösa upp i vatten.
Lösning av jonkristaller i vatten
Eftersom jonkristallen består av laddade partiklar kan vatten, som är en polär vätska, interagera med de individuella jonerna och avlägsna dem från jonkristallen. Desto svagare jonbindningen är, desto mer lösligt blir saltet i vatten.
Eftersom olika salter löser sig varierande i vatten, kan ibland två vätskor med lättlösliga salter blandas och skapa svårlösliga salter som kan fällas ut från lösningen.
Jonkristaller är spröda
Jonkristaller är spröda. Om man applicerar ett tryck på dem som flyttar jonerna i ett plan, så kommer kristallen att spricka. Detta illustreras i bilden nedan.


Metallbindning
Metallbindning är en typ av kemisk bindning där alla metallatomer avsöndrar en eller flera elektroner till ett gemensamt elektronmoln, också känt som elektronhav, vilket omvandlar de enskilda metallatomerna till joner. Dessa joner delar på elektronerna i elektronmolnet som finns utbredd genom hela metallkristallen, vilket ger upphov till olika kemiska bindningar och fenomen.
Metaller har hög kok- och smältpunkt
Metallbinding är i allmänhet mycket stark, och det krävs generellt väldigt mycket värme för att smälta eller koka metaller.
Metaller leder elektricitet
Metaller leder elektricitet mycket effektivt eftersom det finns ett stort antal fria elektroner som inte är bundna till en specifik atom eller jon. Om man tillför elektroner till en sida av en metalltråd, kommer en motsvarande mängd elektroner att “dyka upp” på andra sidan (en stark förenkling av processen).
Metaller är mjuka
Metaller är inte lika sköra som jonkristaller, trots att metallkristallen innehåller joner. En jonkristall går sönder om man förskjuter atomerna i en dimension på grund av att de repellerar varandra. Detta händer inte med metallen då elektronerna rör sig fritt och laddningsskillnaderna finns överallt eller ingenstans beroende på hur man väljer att se på det.


Kovalent bindning


Inom en kovalent bindning delar en atom valenselektroner med en annan atom. Detta skapar ett gemensamt elektronpar där två elektroner delar på bindningen och fungerar som valenselektroner för båda atomerna. Denna process närmare båda atomerna att uppfylla oktettregeln.
En kovalent bindning kan vara en enkelbindning (2 elektroner), dubbelbindning (4 elektroner) eller trippelbindning (6 elektroner). I bilden till höger visas en enkelbindning. Beskrivningen av de andra typerna av bindningar finns i artikeln om strukturformler.
Elektronerna är inte alltid jämnt fördelade
En kovalent bindning kan vara asymmetrisk, vilket innebär att elektronerna är förskjutna åt en riktning i molekylen. Ett exempel på en molekyl med asymmetrisk kovalent bindning är vatten. Eftersom syret är mer elektronegativt än väten, innebär det att elektronerna befinner sig närmare syret än vätena.
En molekyl kan också vara en dipol om det finns en asymmetrisk kovalent bindning som inte har symmetri i molekylen. Vatten har väteatomer placerade så att kovalenta bindningar till syret inte skapar symmetri inom molekylen. Vattenmolekylen har en övergripande laddningsförskjutning. Åt syrets håll är molekylen svagt negativt laddad, och åt vätenas håll är den svagt positivt laddad.
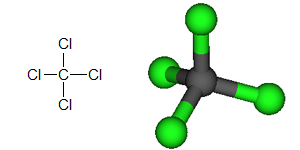
Koltetraklorid (CCl4) är en molekyl med en asymmetrisk kovalent bindning där molekylen totalt sett fortfarande är opolär. De fyra kloratomerna som är bundna till kol bildar en symmetrisk struktur runt kolatomen, vilket leder till att det inte finns någon övergripande laddningsförskjutning. För mer information, se artikeln om polaritet.
Elektronegativitet
Ett centralt begrepp för att förstå polaritet är elektronegativitet, vilket kan beskrivas som en atoms förmåga att attrahera elektroner. Om en substans har en hög elektronegativitet kommer den att utöva en stark dragkraft på elektronerna i de bindningar den bildar med andra ämnen.
Elektronegativitetsskalan
Efter många experiment har en skala över varje atomslags elektronegativitet fastställts och kallas Pauling-skalan. Ni kan se Pauling-skalan applicerad på ett periodiskt system här. Ämnen med hög elektronegativitet återfinns i övre högra hörnet av det periodiska systemet, medan de med låg elektronegativitet finns längst ned till vänster. Eftersom skalan ändras gradvis från vänster till höger och upp till ned, kan man göra en grov uppskattning av ett ämnes elektronegativitet om man känner till elektronegativiteten hos närliggande ämnen. För mer information, se vår artikel om trender i det periodiska systemet.
Bindningstyper baserat på elektronegativitet
En direkt konsekvens av elektronegativiteten är att om vi skapar en bindning där båda atomerna har liknande elektronegativitet, kommer de att dela de två elektronerna jämnt. Om det föreligger en liten skillnad i elektronegativitet kommer en av atomerna att attrahera elektronerna något starkare och bli svagt negativt laddad, medan den andra kommer att attrahera dem något mindre och bli svagt positivt laddad. Om vi skapar en bindning där en atom attraherar elektronerna betydligt starkare kommer de båda elektronerna i bindningen att tillhöra den ena atomen.
Den intressanta aspekten är att elektronegativiteten avgör om en bindning är kovalent, polär kovalent eller jonbindning, vilket beskrivs nedan:


Ren kovalent bindning
Vi kan börja med att undersöka fallet när det inte förekommer någon skillnad i elektronegativitet, vilket betyder att atomerna delar elektroner jämnt i bindningen. En “ren” kovalent bindning är endast möjlig mellan två atomer av samma slag.
Kovalent bindning
Så fort vi har en skillnad i elektronegativitet över 0 så är det inte en ren kovalent bindning längre. Det kallas då bara för en kovalent bindning. En elektronegativitetsskillnad upp till 0,4 räknas som en icke-polär kovalent bindning.
Polär kovalent bindning
En elektronegativitetsskillnad på över 0,4 men under 2,0 innebär att bindningen är polär kovalent. Här är elektronerna förskjutna mot den mest elektronegativa på ett sätt som kan märkas på molekylens egenskaper.
Jonbindning
En elektronegativitetsskillnad på över 2,0 brukar betecknas som en jonbindning. Här äger den ena atomen i bindningen mer eller mindre båda elektronerna, och har därmed ”tagit” en elektron från den andra atomen.
Dessa gränser är givetvis flytande, vissa ämnen över 2,0 i elektronegativtetsskillnad uppvisar inte saltegenskaper, och vissa ämnen under 2,0 i elektronegativitetsskillnad uppvisar mer saltegenskaper.
Polaritet
Polaritet innebär att det finns en del av en molekyl som har en annorlunda laddning än en annan del av samma molekyl. I denna artikel kommer vi att reda ut innebörden av detta begrepp. Innan du läser den här artikeln kan det vara till nytta att ha gått igenom artikeln om elektronegativitet.
För att åstadkomma polaritet måste vi ha ett överskott på elektroner på ett ställe, och ett underskott på ett annat i molekylen.
Polära kovalenta bindningar
För att en molekyl ska vara polär måste den innehålla polära kovalenta bindningar. Om det inte finns sådana bindningar kommer molekylen automatiskt klassificeras som opolär. Ett exempel på ett opolärt ämne är kolväten, där bindningen mellan kol och väte inte är tillräckligt polär för att klassificeras som en polär kovalent bindning.
Avsaknad av symmetri
Det andra kriteriet är att molekylen ska vara asymmetrisk. I det här fallet betyder asymmetri att laddningens centrala plats i molekylen inte sammanfaller med molekylens geografiska centrum. Om vi placerar polära kovalenta bindningar jämnt runt om i molekylen så att laddningen och geografiska mitten hamnar på samma plats, då blir molekylen inte polär. Om vi däremot har alla kovalenta bindningar å ena sidan av molekylen, då kommer laddningen att vara förskjuten så att den inte längre sammanfaller med molekylens centrum, och molekylen blir då polär. Detta kan vara lite komplicerat eftersom man måste uppmärksamma symmetrin i alla tre dimensioner.
Ta till exempel koltetraklorid (se bilden nedan). Den här föreningen har ett kolatom i mitten som är bundet till fyra polära kovalenta bindningar med kloratomer. Även om molekylen innehåller polära kovalenta bindningar, är den symmetrisk eftersom de polära bindningarna är jämnt fördelade runt kolatomens centrum. Detta resulterar i att molekylen, trots att den innehåller polära kovalenta bindningar, inte är polär.

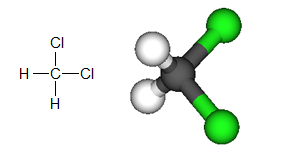
Om vi istället tittar på diklormetan (se bilden nedan), så har vi två polära kovalenta bindningar till klor och två kovalenta bindningar till väte. Man kan tänka sig att man kan placera ut dessa två polära bindningar på ett symmetriskt sätt för att skapa en opolär molekyl, men det går inte. Detta fungerar i teorin eftersom man bara kan uttrycka molekylen i två dimensioner. I verkligheten har molekylen tre dimensioner, och vinkeln mellan de två polära kovalenta bindningarna är ungefär 109,5°. Detta gör att laddningens centrum inte helt sammanfaller med molekylens centrum, vilket resulterar i att molekylen är polär.

Att beskriva polaritet


Det finns flera sätt att beskriva polaritet i kemiska strukturer. En metod (1. i bilden) involverar användningen av δ+ och δ−. Här betyder delta (δ) att det finns en liten laddningsseparation, och inte nödvändigtvis att en hel elektron har flyttats. Delta har ingen fastställd storlek utan representerar bara en odefinierad, liten laddning.
För att förenkla beskrivningen används ibland siffror tillsammans med delta för att approximativt ange laddningens storlek i förhållande till andra laddningar (2. i bilden). Båda dessa metoder används i undervisningen och anses vara acceptabla.
En annan metod är att använda ett så kallat dipolmoment (3. i bilden), som beskriver skillnaden mellan positiv och negativ laddning i en molekyl med hjälp av en pil. Pilens bas indikerar positionen för den positiva laddningen och spetsen för den negativa. Denna pil representerar den sammanlagda laddningsfördelningen i molekylen och tar inte hänsyn till de enskilda bindningarnas inverkan.
Skillnaden mellan polaritet och dipol
Hittills har vi diskuterat polaritet som en egenskap hos molekyler samt begreppet dipol. Motsatsen mellan de två är att “polär” är ett mer allmänt begrepp. En molekyl med flera olika funktionella grupper kan vara polär även om den inte har en tydlig total laddningsförskjutning med en klar positiv och negativ del. Det betyder att det finns molekyler som är polära men inte är dipoler, till exempel glukos. Å andra sidan är alla dipoler mer eller mindre polära, beroende på styrkan av deras dipolmoment.
Intermolekylära bindningar
Intermolekylära bindningar är de bindningar som förekommer mellan olika molekyler. Dessa bindningar kan också kallas för intermolekylära krafter.
Typer av intermolekylära bindningar
- Van der Waalsbindning (van der Waalskraft) − där temporära förändringar i elektronmolnen ger upphov till svaga dipol-dipol-interaktioner, och därmed attraktion.
- Dipol-dipol-bindning − där permanenta dipoler attraherar varandra via svaga laddningsskillnader.
- Vätebindning − En starkare variant av dipol-dipol-bindningen som kan uppstå när väte binder till F, O eller N.
Olika starka intermolekylära bindningar
Om vi rangordnar styrkan hos de olika krafterna ser det ut såhär:


Samspel mellan de olika intermolekylära krafterna
Av våra tre typer av intermolekylära bindningar är två beroende av polaritet. Detta innebär att dipoler och ämnen som kan bilda vätebindningar interagerar väl med varandra och löser sig enkelt i varandra. Ämnen med vätebindningar och dipol-dipolbindningar (polära ämnen) löser sig vanligen väl i varandra. Däremot interagerar opolära ämnen, som enbart binder med hjälp av Van der Waals-krafter, mycket dåligt med polära molekyler (dipoler och ämnen med förutsättningar för vätebindning).
Van der Waalsbindning
Van der Waals-bindning (Van der Waals-kraft) förekommer mellan alla atomer och molekyler. Den uppstår på grund av tillfälliga förändringar i elektronmolnet runt en atom eller molekyl, vilket temporärt skapar en svag dipol. I respons till detta, upplever det elektronmolnet i närliggande atomer eller molekyler förändringar, vilket ger upphov till en kortvarig och svag attraktion mellan dem.
Hur fungerar Van der Waalsbindningar?
Elektronmolnet är det område omkring en atom eller molekyl där dess elektroner kan befinna sig. Elektronmolnet förändras ständigt slumpmässigt, vilket innebär att det under vissa tillfällen kan ske en ansamling av elektroner på en viss sida av atomen eller molekylen. Eftersom det då sker en ansamling av elektroner blir denna sida svagt negativt laddad medan den andra sidan blir svagt positivt laddad på grund av brist på elektroner. När andra atomer eller molekyler finns i närheten påverkar dessa deras egna elektronmoln. Om molekyl 1 temporärt riktar en negativ del mot molekyl 2 kommer molekyl 2:s elektroner att undvika detta område, vilket ger upphov till en svag positiv laddning. Detta skapar en kortvarig attraktion mellan molekylerna. Denna interaktion försvinner när elektronmolnen justeras om några ögonblick senare.
Var finns Van der Waalsbindningar?
Alla atomer och molekyler påverkas av Van der Waals-bindningar. Detta kan betraktas som en grundläggande attraktiv kraft som alla atomer och molekyler kan interagera genom. Van der Waals-bindningar är emellertid mycket svaga, så om det finns en annan typ av bindning närvarande, till exempel dipol-dipol-bindningar eller vätebindningar, kommer Van der Waals-krafterna att maskeras. En analogi skulle vara att sätta ihop två föremål med antingen en tejp eller tejp tillsammans med superlim. Bindningsstyrkan hos tejpbandet kommer inte att påverka ifall superlimmet används samtidigt.
Var är Van der Waalsbindningar mest framträdande?
I opolära molekyler och atomer är Van der Waals-bindningar mest framträdande eftersom dessa binder främst i avsaknad av andra intermolekylära krafter. Opolära ämnen har mycket låg smält- och kokpunkt eftersom deras atomer och molekyler är svagt bundna till varandra.
Dipol-dipolbindning
En dipol, såsom tidigare nämnt, är en molekyl med en svag laddningsförskjutning. Eftersom dessa laddningsskillnader är permanenta, kommer dipolerna att påverka varandra i mycket större utsträckning än vad Van der Waals-bindningarna gör. När två dipoler placeras intill varandra kommer de att orientera sig så att de dras mot varandra. Denna interaktion kallas dipol-dipolbindning, en intermolekylär kraft som är starkare än Van der Waals-bindningar, men svagare än vätebindningar. Ämnen med dipol-dipolbindningar har en högre smält- och kokpunkt än opolära molekyler, men lägre än ämnen med vätebindningar.
Vätebindning
En vätebindning uppstår när väte binder till fluor (F), syre (O) eller kväve (N). En enkel regel att komma ihåg är “FON-regeln”: väte måste binda till F, O eller N för att en vätebindning ska uppstå.
De mycket höga elektronegativiteterna hos fluor (F), syre (O) och kväve (N) resulterar i en stark elektronförflyttning bort från väte, vilket skapar en mycket stark dipol. Ett typiskt exempel på en vätebindning är vattenmolekylen, där väte bindes till syre. Det positivt laddade väte kommer att rikta sig mot syret i en annan vattenmolekyl, och syrets väte kommer i sin tur att rikta sig mot syret i ytterligare en molekyl, och så vidare. Ämnen med vätebindning har mycket högre smält- och kokpunkt än vad man skulle förvänta sig för ämnen i samma storleksordning som inte har vätebindningar.
Vätebindningen är en förstärkt form av dipol-dipolbindning som endast uppträder när FON-regeln är uppfylld. Vätebindningen skapar med andra ord en kraftigare dipol, vilken ibland är tillräckligt stark för att lösa upp salter om ämnet i sig är flytande. Vätebindningen är avgörande för egenskaperna hos vatten och för att DNA-dubbelhelixen i våra celler ska behålla sin struktur.

